Аланиновый цикл и цикл кори
Глюкоза
+ 2 АДФ + 2 H3PO4 =
2 Лактат + 2 АТФ + 2 Н2О
В
анаэробном гликолизе АТФ образуется
только за счет субстратного фосфорилирования
(2
моль АТФ на 1моль глюкозы).
Значение
анаэробного гликолиза особенно велико
для скелетных мышц. В интенсивно
работающих скелетных мышцах мощность
механизма транспорта кислорода
оказывается недостаточной для обеспечения
энергетической потребности, в этих
условиях резко усиливается анаэробный
гликолиз, и в мышцах накапливается
молочная кислота. Особое значение
анаэробный гликолиз имеет при
кратковременной интенсивной работе.
Так, бег в течение 30 с полностью
обеспечивается анаэробным гликолизом.
Однако уже через 4-5 мин бега энергия
поставляется поровну анаэробным и
аэробным процессами, а через 30 мин —
почти целиком аэробным процессом. При
длительной работе в аэробном процессе
используется не глюкоза, а жирные
кислоты.
Эритроциты
вообще не имеют митохондрий, поэтому
их потребность в АТФ удовлетворяется
только за счет анаэробного гликолиза.
Интенсивный гликолиз характерен также
для злокачественных опухолей.
Цикл Кори (глюкозо-лактатный цикл) и глюкозо-аланиновый цикл.
Молочная
кислота не является конечным продуктом
обмена, но ее образование — тупиковый
путь метаболизма: ее дальнейшее
использование связано опять с превращением
в пируват. Из клеток, в которых происходит
гликолиз, образующаяся молочная кислота
поступает в кровь и улавливается в
основном печенью, где и превращается в
пируват. Пируват в печени частично
окисляется, а частично превращается в
глюкозу. Часть пирувата в мышцах путем
трансаминирования превращается в
аланин, который транспортируется в
печень, и здесь снова образует пируват.
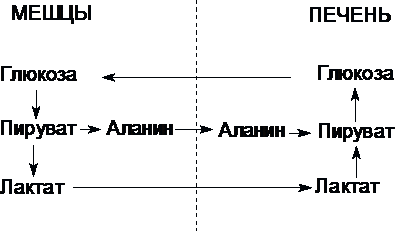
Рис.
Цикл Кори и глюкозо-аланиновый цикл
Биосинтез глюкозы (глюконеогенез).
Глюконеогенез
протекает в основном по тому же пути,
что и гликолиз, но в обратном направлении.
Однако три реакции гликолиза необратимы,
и на этих стадиях реакции глюконеогенеза
отличаются от реакций гликолиза.
Обходные пути глюконеогенеза.
I.
Первый обходной путь — превращение
пирувата в фосфоенолпируват.
Это
превращение осуществляется под действием
двух ферментов — пируваткарбоксилазы
(Е1) и карбокикиназы
фосфоенолпирувата (Е2).
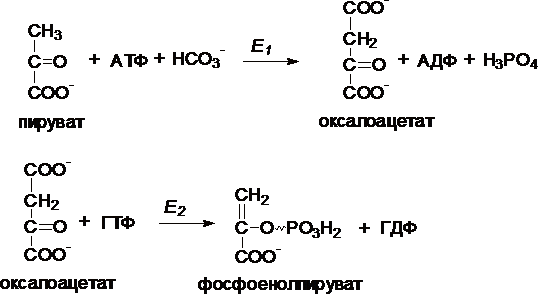
II. Превращение
фруктозо-1,6-дифосфата во
фруктозо-6-фосфат катализирует
фермент фруктозо-1,6-дифосфатаза.
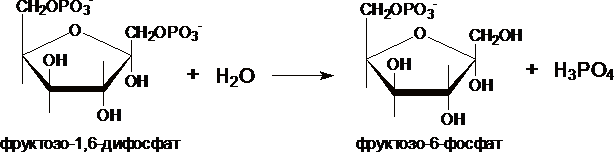
III. Образование
глюкозы из глюкозо-6-фосфата катализирует
фермент глюкозо-6-фосфотаза .
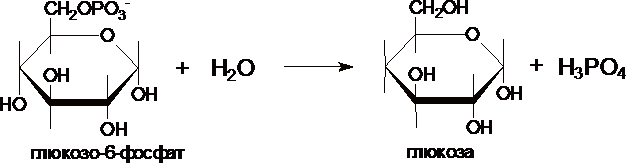
Этот
фермент отсутствует в клетках мозга,
скелетных мышц и др. тканях, поэтому
глюконеогенез, протекающий в этих тканях
не может поставлять глюкозу в кровь.
Глюкозо-6-фосфатаза локализована в
почках и, особенно, в печени, и
глюкозо-6-фосфат может превращаться в
глюкозу, если ее уровень в крови снижен.
Пентозофосфатный путь (пфп). Значение пфп.
Большая
часть глюкозы расщепляется по
гликолитическому пути. Наряду с гликолизом
существуют второстепенные пути
катаболизма глюкозы, одним из которых
является пентозофосфатный путь (ПФП).
Пентозофосфатный путь скорее даже —
анаболический путь, который использует
6 атомов С глюкозы для синтеза пентоз и
восстановительных эквивалентов в виде
НАДФН, необходимых для образования
липидов в организме. Однако, этот путь
— окисление глюкозы, и при определенных
условиях может завершиться полным
окислением глюкозы до СО2 и
Н2О.
Главные функции этого цикла следующие:
Генерирование
восстановительных эквивалентов в виде
НАДФН для восстановительных реакций
биосинтеза. Ферменты, которые катализируют
реакции восстановления, часто используют
в качестве кофактора НАДФ+/НАДФН,
а окислительные ферменты — НАД+/НАДН.
Восстановительные реакции биосинтеза
жирных кислот и стероидных гормонов
требуют НАДФН, поэтому клетки печени,
жировой ткани и др., где протекает синтез
липидов, имеют высокий уровень ферментов
ПФП. В печени около 30% глюкозы подвергаются
превращениям в
ПФП.
НАДФН
используется при обезвреживании лекарств
и чужеродных веществ в монооксигеназной
цепи окисления в печени.
НАДФН
предохраняет ненасыщенные жирные
кислоты эритроцитарной мембраны от
аномальных взаимодействий с активным
кислородом. Кроме того, эритроциты
используют реакции ПФП для генерирования
больших количеств НАДФН, который
необходим для восстановления глутатиона,
участвующего в системе обезвреживания
активного кислорода, что позволяет
поддерживать нормальную степень
окисления Fe2+ в
гемоглобине.
Снабжение
клеток рибозо-5-фосфатом для синтеза
нуклеотидов, нуклеотидных коферментов
и нуклеиновых кислот. Превращение
рибонуклеотидов в дезоксирибонуклеотиды
также требует НАДФН, поэтому многие
быстро пролиферирующие клетки требуют
больших количеств НАДФН.
Хотя
это не значительная функция ПФП, он
принимает участие в метаболизме пищевых
пентоз, входящих в состав нуклеиновых
кислот пищи и может превращать их
углеродный скелет в интермедиаты
гликолиза и глюконеогенеза.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
22.05.201511.34 Mб27Вазопатии. Геморрагический васкулит.Лейкозы Ч2.pdf
- #
- #
Источник
Глюконеогенез – путь образования глюкозы denovo из низкомолекулярных метаболитов углеводного обмена цикла Кребса и соединений неуглеводной природы. Поддерживает уровень глюкозы в крови в период длительного голодания и интесивных физических нагрузок.Локализуется в печени,в корковом веществе почек, в слизистый оболочке кишечника.Первичные субстраты: лактат, аминокислоты и глицерол. Ключевые реакции гликонеогенеза: 1.Гексокеназная реакция обходится за счет глюкозо-6-фосфатазы. 2.Фосфофруктокеназная реакция обходится за счет фруктозо-1,6-дифосфатазы. 3.Пируваткеназная реакция протекает по двум путям. В первом пути ПВК под влиянием пируваткарбоксилазы превращается в ЩУК. А затем ФЭП-карбоксиназа превращает ЩУК в ФЭП. Во втором пути – при помощи малатфермента ПВК ->малат -> (малатдегидрогениза) ЩУК. ФЭП-карбоксикеназа превращает ЩУК в ФЭП в цепи гликонеогенеза, его недостаток приводит к смерти «в колыбели».
Регуляция глюконеогенеза
Гормональная активация глюконеогенеза осуществляется глюкокортикоидами, которые увеличивают синтез пируваткарбоксилазы, фосфоенолпируват-карбоксикиназы, фруктозо-1,6-дифосфатазы. Глюкагон стимулирует те же самые ферменты через аденилатциклазный механизм путем фосфорилирования.
Также имеется метаболическая регуляция, при которой аллостерически активируется пируваткарбоксилаза при помощи ацетил-SКоА, фруктозо-1,6-дифосфатаза при участии АТФ.
Гормональные и метаболические факторы, регулирующие гликолиз и глюконеогенез
Регуляция гликолиза
Гликолиз стимулируется инсулином, повышающим количество молекул гексокиназы, фосфофруктокиназы, пируваткиназы.
В печени активность глюкокиназы регулируется гормонами: активацию вызывает инсулин и андрогены, подавляют ее активность глюкокортикоиды и эстрогены.
Для метаболической регуляции чувствительной является фосфофруктокиназа. Она активируется АМФ и собственным субстратом, ингибируется – АТФ, лимонной кислотой, жирными кислотами. Пируваткиназа активируется фруктозо-1,6-дифосфатом. Гексокиназанепеченочных клеток ингибируется продуктом собственной реакции – глюкозо-6-фосфатом.
Цикл Кори(глюкозолактатный цикл)
Лактат, образовавшийся в интенсивно работающих мышцах или в клетках с преобладающим анаэробным способом катаболизма глюкозы, поступает в кровь, а затем в печень .в печени отношение NADH/NAD ниже, чем в сокращающейся мышце, поэтому лактатдегидрогеназная реакция протекает в обратном направление, т.е. в сторону образования пирувата из лактата .Далее пируват включается в глюконеогенез, а образовавшаяся глюкоза поступает в кровь и поглащается скелетным мышцами.Цикл Кори включает 2 важные функции:
1-обеспечивает утилизация лактата.
2-предотвращает накопление лактата.
Глюкозо-аланиновый цикл:
Глюкоза в мышцах – пируват в мышцах- аланин в мышцах-аланин в печени – глюкоза в печени – глюкоза в мышцах.
Весь цикл не приводит к увеличению количества глюкозы в мышцах,но он решает проблемы транспорта аминного азота из мышц в печень и предотвращает лактоацидоз.
Билет 9
Обратимые ингибиторы связанные с ферментом слабыми нековолентными связями и при опред условиях легко отделяются от ф-тов.
Бывают: конкурентными (обратимое снижение скорости ферментативной реккции,вызванноеингибитором,связываясь с активным центром и препятствуя образованию фермент-субстратного комплекса); неконкурентные (ингибитор взаимодействует с фер-том в участке, отличном от активного центра). Необратимое ингибирование наблюдается в случае образования ковалентных связей между молекулами ингибитора и ф-та. Модификации подвергается актив центр, и ф-т не вып кат ф-ий (ионы Ме:Hg, Ag). Многие лек препараты оказывают терапевтическое действие по мех конкурентного ингибирования. Четвертичные аммониевые основания ингибируют ацетилхолинэстеразу, катализирующюю р-ю гидролиза ацетилхолина на холин и уксусную к-ту. При добавлении ингибиторов, активность ацетилхолистеразы уменьшается, конц субстрата увелич, что сопровождается усилением проведения нервного импульса. Ингибитора холинэстеразы используются про лечении мышечных дистрофий.
2)Глюконеогенез – путь образования глюкозы из низкомолекулярных метаболитов углеводного обмена цикла Кребса и соединений неуглеводной природы. По своей значимости вводит гораздо больший вклад в поддержание глюкозы в крови, чем гликогенолиз. Ключевые реакции гликонеогенеза: 1.Гексокеназная реакция обходится за счет глюкозо-6-фосфатазы. 2.Фосфофруктокеназная реакция обходится за счет фруктозо-1,6-дифосфатазы. 3.Пируваткеназная реакция протекает по двум путям. В первом пути ПВК под влиянием пируваткарбоксилазы превращается в ЩУК. А затем ФЭП-карбоксиназа превращает ЩУК в ФЭП. Во втором пути – при помощи малатфермента ПВК ->малат -> (малатдегидрогениза) ЩУК. ФЭП-карбоксикеназа превращает ЩУК в ФЭП в цепи гликонеогенеза, его недостаток приводит к смерти «в колыбели».
Цикл Кори(глюкозолактатный цикл)
Реакци
Источники субстрата гликонеогенеза.Мышечная ткань-главный источник субстратов гликонеогенеза. Существуют гликогенные аминокислоты(аланин,аспарагиновая кислота)
В ходе реакций переаминирования они превращаются в кетокислоты. По схеме глюкозоаланиновый цикл.
РЕАКЦИЯ
При длительном голодании белки мышечной ткани явл. важнейшим резервом гликонеогенеза. Эндокринная регуляция гликонеогенеза. Важнейшими активаторами гликонеогенеза – гормоны глюкокортикоиды. Они осуществляют эффект на уровне генома способствуя биосинтезу ферментов: ФЭП и карбоксикеназы и трансаминаз.
Билет 10
Источник
Метаболическая регуляция мышечного сокращения
А. Циклы Кори и
аланина
В клетках, не содержащих митохондрий
(например, в эритроцитах), или в тканях при недостаточном снабжении кислородом
(например, в активно работающих мышцах) АТФ (АТР) синтезируется за счет процесса
превращений глюкозы в лактат, т. е. за счет процесса брожения (= анаэробного
гликолиза, см. рис. 153). Лактат переносится кровью в печень, где в
процессе глюконеогенеза с затратой АТФ (см. рис. 157) вновь конвертируется
в глюкозу (цикл Кори).
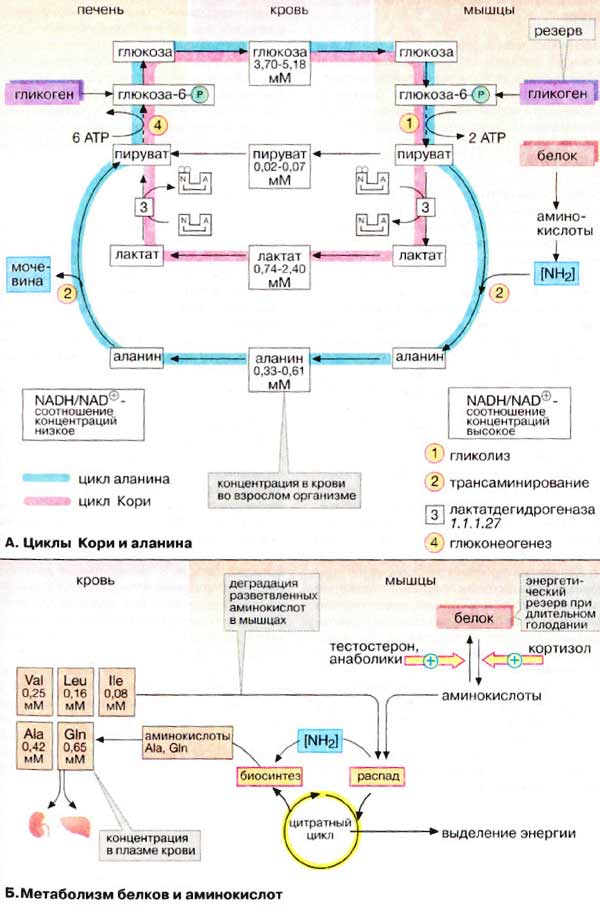
При интенсивной работе мышцы максимально
активируется гликолиз. Продукт гликолиза, пировиноградная кислота (пируват)
накапливается в цитоплазме и недостаточно быстро поступает в митохондрии, если
они из-за недостатка кислорода не готовы к окислению пирувата. В анаэробных
условиях пируват в реакции, катализируемой лактатдегидрогеназой (см. рис.
103) (заключительный этап гликолиза) восстанавливается до лактата.
Одновременно
НАДН (NADH), кофермент лактатдегидрогеназы, окисляется до НАД+
(NAD+), который вновь используется на окислительном этапе
гликолитического пути. Этой реакции способствует относительно высокое отношение
НАДН/НАД+ в мышечной ткани. Лактат диффундирует в кровь и поступает в
печень, где конвертируется в глюкозу. Таким образом, образование лактата
временно заменяет аэробный метаболизм глюкозы и частично переносит этот процесс
из мышц в печень.
Обратная связь, подобная циклу Кори,
существует в цикле аланина, в котором также участвует пируват.
Цикл аланина берет начало с протеолиза белков. Образующиеся аминокислоты
в результате трансаминирования в присутствии ферментов превращаются в
α-кетокислоты (на схеме не приведено, см. рис. 181), которые в основном включаются
в цикл трикарбоновых кислот (цитратный цикл) (см. рис. 183).Одновременно в
реакции, катализируемой аланинтрансаминазой, аминогруппы из разных аминокислот
переносятся на имеющийся субстрат, пируват. Образующийся аланин поступает
в кровь и переносится в печень. Таким образом, цикл аланина служит каналом
передачи азота и предшественников глюкозы в печень, которая является местом
синтеза конечных продуктов азотистого обмена, например мочевины (см. рис.
185).
Следует напомнить, что при анаэробном
гликолизе образуются кислоты, которые, не принимая участие в последующем обмене,
существуют в форме анионов. Поэтому при интенсивном анаэробном гликолизе рН
мышечной клетки может понизиться настолько, что сокращение станет невозможным.
Обычно этого не происходит благодаря быстрому выходу кислых метаболитов (лактата
и пирувата) в кровь, которая также может оказаться закисленной
(метаболический ацидоз).
Б. Метаболизм белков и
аминокислот
Скелетные мышцы активно участвуют в
метаболизме аминокислот. Это наиболее важный участок деградации разветвленных
аминокислот (Val и Ile, см. с. 402). Ряд других аминокислот также
деградируются преимущественно в мышцах. Одновременно идет ресинтез и
высвобождение в кровь аланина и глутамина. Эти аминокислоты служат
переносчиками азота, образующегося при расщеплении белков, в печень (цикл
аланина) и почки (см. рис. 319).
При голодании мышечные белки
служат энергетическим резервом организма. Они гидролизуются до аминокислот,
которые поступают в печень. Здесь углеродный скелет аминокислот конвертируется в
промежуточные продукты цитратного цикла, в том числе в ацетоацетил-КоА и
ацетил-КоА (см. рис. 183). Эти амфиболические соединения окисляются в цикле
трикарбоновых кислот или включаются в процесс
глюконеогенеза.
Синтез и расщепление мышечных белков
контролируются гормонами. Тестостерон и синтетические анаболики
стимулируют биосинтез белка; напротив, кортизол подавляет образование
мышечных белков.
Белки актин и миозин содержат остатки
гистидина, метилированного на стадии посттрансляционной модификации. При
расщеплении этих белков образуется 3-метилгистидин, который дальше не
разрушается. Количество метилгистидина в моче служит мерой деградации мышечных
белков.

Источник
Глюконеогенез. Цикл кори и глюкозо- аланиновый цикл: физиологическое значение Цикл Кори — совокупность биохимических ферментативных процессов транспорта лактата из мышц печень, и дальнейшего синтеза глюкозы из лактата, катализируемое ферментами глюконеогенеза. . Глюкозо-аланиновый цикл. Этот цикл выполняет две функции 1) переносит аминогруппы из скелетных мышц в печень, где они превращаются в мочевину, и 2) обеспечивает работающие мышцы глюкозой, поступающей с кровью из печени, где для ее образования используется углеродный скелет аланина.
Пентозофосфатный путь окисления глюкозы, сущность, значение, распространение.
Пентозофосфа́тный путь (пентозный путь, гексозомонофосфатный шунт[1], путь Варбурга — Диккенса — Хорекера[2]) — альтернативный путь окисления глюкозы (наряду с гликолизом и путём Энтнера — Дудорова), включает в себя окислительный и неокислительный этапы.Суммарное уравнение пентозофосфатного пути: 3 глюкозо-6-фосфат + 6 NADP+ → 3СО2 + 6 (NADPH + Н+) + 2 фруктозо-6-фосфат[en] + глицеральдегид-3-фосфат[3]. Пентозофосфатный путь распространён у растений и животных, а у большинства микроорганизмов имеет только вспомогательное значение[2]. Ферменты пентозофосфатного пути располагаются в цитозоле и животных, и растительных клеток; кроме того, в клетках млекопитающих они располагаются также в эндоплазматическом ретикулуме, а у растений — в хлоропластах[4].
Конечные продукты обмена углеводов. Реакции в результате которых они образуются. Выделение.
Конечными продуктами распада углеводов в тканях являются вода и углекислый газ. Конечными продуктами биологического окисления являются вода и двуокись углерода. Субстратами биологического окисления являются продукты превращений жиров, белков и углеводов. Окисление биологическое — совокупность окислительно-восстановительных реакций, протекающих в биологических объектах. Под процессом окисления понимают потерю веществом электронов или электронов и протонов одновременно (потерю водородных атомов) или присоединение кислорода. Реакции противоположного направления характеризуют процесс восстановления. Восстановителями называют вещества, теряющие электроны, окислителями — вещества, приобретающие электроны. Окисление биологическое составляет основу тканевого, или клеточного, дыхания (процесса, в результате которого ткани и клетки поглощают кислород и выделяют углекислый газ и воду) — главного источника энергии для организма. Веществом, принимающим (акцептирующим) электроны, т. е. восстанавливающимся, является молекулярный кислород, превращающийся в анион кислорода O——. Водородные атомы, отщепляемые от органического вещества — субстрата окисления (SH2), превращаются при потере электронов в протоны или положительно заряженные катионы водорода:
SH2→S→2H; 2Н→2H+ + 2e: ½O2→О; О→2е→O——; 2H+ + O——→H2O+55 ккал. В результате реакции между катионами водорода и анионами кислорода образуется вода, а реакция сопровождается выделением значительного количества энергии на каждые 18 г воды). В качестве побочного продукта биологического окисления образуется углекислый газ.
Липиды пищи, биологическое значение, переваривание, всасывание в желудочно-кишечном тракте. Роль и состав мицелл.
С пищей поступает большое количество липидов – 60-80г/сут. Рекомендуется поступление липидов на уровне 30% суточного калоража, причем доля растительных липидов от этого общего количества должна быть не менее 30%. Основными липидами пищи являются следующие:ТАГ – 99% пищевых липидов – 1) энергетический материал, окисление 1 г ТАГ сопровождается выделением 38,9кДж (9,3ккал) энергии. В ТАГах тела здорового человека массой 70кг одновременно заключено 140млнкалорий (140тыс ккал). Это в 100 раз больше, чем может дать весь гликоген организма; 2) источники эндогенной воды, окисление 100 г дает 107мл воды. Это имеет особое значение для животных, впадающих в спячку; 3) механическая, или защитная функция – органы находятся в жировых капсулах; 4) структурная роль – ТАГ в небольших количествах входят в мембраны; 5) ТАГ участвуют в теплорегуляции – плохие проводники тепла.ФЛ делятся на 2 группы: фосфоглицериды (ФХ, ФС, ФЭА, ФИ, кардиолипины, плазмологены) и сфинглилипиды (церамиды и сфингомиелины). Выполняют:структурную роль – из общего количества липидов мембран составляют более 50 % и образуют билипидный слой;входят в состав транспортных форм липидов – мицелл, ХМ и ЛП и участвуют в эмульгировании, переваривании, всасывании и транспорте липидов по организму;
некоторые ФЛ участвуют в свертывании крови, например, ФЭА и ФС;липотропное действие – ФЛ предохранют печень от ожирения;
Источник


