Астма нестероидные противовоспалительные средства
Кортикостероиды, кромогликат натрия, недокромил натрия в лечении бронхиальной астмы. Нестероидные противовоспалительные препараты. Аспириновая бронхиальная астма: распространенность, патогенез, диагностика и лечение. Нимесулид.
Бьянко С., Робуши M., Петриньи Дж., Скури M., Пьерони M.Дж., Рефини Р.M., Ваджи A., Сестини П.С.
Бронхиальная астма – это хроническое воспалительное заболевание дыхательных путей, при котором взаимодействие провоспалительных клеток и медиаторов воспаления вызывает гиперреактивность бронхов и бронхоспазм. В свете того, что центральным звеном патогенеза бронхиальной астмы является воспаление [Djukanovic и др., 1990 г.; Laitinen и др., 1985 г.], основой медикаментозной терапии заболевания является регулярный прием противовоспалительных препаратов. Бронходилататоры следует назначать только при выраженном бронхоспазме.
Наиболее эффективными противовоспалительными препаратами для лечения бронхиальной астмы являются кортикостероиды и, в меньшей степени, кромогликат натрия и недокромил натрия. Другие противовоспалительные препараты, вт.ч. тролеандомицин, метотрексат, золото, гидроксихлорохин, дапсон и циклоспорин, обладают стероидсберегающим эффектом. Однако эффективность этих препаратов изучена недостаточно, хотя некоторые из них пациенты переносят лучше, чем высокие дозы пероральных кортикостероидов [Szefler, 1992 г.; Thomson и др., 1992 г.; Van Bever и Stevens, 1992].
Нестероидные противовоспалительные препараты (НПВП), являющиеся ингибиторами циклооксигеназы, такие как аспирин (ацетилсалициловая кислота (АСК)) или индометацин, никогда не рассматривались в качестве средств для лечения бронхиальной астмы по двум причинам.
Во–первых, в нескольких исследованиях, направленных на изучение острых и подострых состояний (в основном с использованием индометацина), протективный эффект в отношении различных стимулов, вт.ч. метахолина, гистамина, лейкотриена (ЛТ) D4, физической нагрузки, гипервентиляции, воды (распыление с помощью ультразвука), гипертонического раствора хлорида натрия, аденозина и аллергенов (немедленные и отсроченные аллергические реакции) не наблюдался или был умеренно выражен [Bianco и др, 1991 г. a,b]. Вторая, более важная причина заключается в том, что АСК и другие НПВП могут вызвать у пациентов с бронхиальной астмой бронхообструкцию тяжелой степени тяжести, которая в некоторых случаях угрожает жизни больного [Bianco, 1986 г.; Samter и Beers, 1968 г.; Szczeklik, 1986 г.]. Такая непереносимость создает большое количество трудностей, поскольку НПВП назначают не только в качестве противовоспалительных, но и в качестве жаропонижающих и обезболивающих средств.
Аспириновая бронхиальная астма
Частота встречаемости и распространенность
Частота встречаемости непереносимости АСК среди взрослых, страдающих бронхиальной астмой, колеблется в пределах от 5 до 30 % (более точные данные Bianco 1986 г. ~ 10 %). Аспириновая бронхиальная астма – это приобретенное заболевание, которое не развивается у детей до 10 лет; в возрастной группе от 10 до 40 – 50 лет частота встречаемости заболевания увеличивается, а после 50 лет – постепенно уменьшается. Аспириновой бронхиальной астмой чаще болеют женщины, чем мужчины. Кроме того, у пациентов, страдающих аспириновой бронхиальной астмой, кожные аллергологические пробы со стандартными аллергенами часто бывают отрицательными, тогда как достаточно часто (~ 60 %) встречается полипоз носа (при тщательном осмотре оториноларинголога).
Теории патогенеза
Хотя механизм развития аспириновой бронхиальной астмы до конца не выяснен, существует несколько теорий патогенеза заболевания. Многие теории, в основу которых положены, например, реакции антиген–антитело, окисление белков, стимуляция рецепторов брадикинина, активация комплемента, имеют только исторический интерес. В основу наиболее достоверной современной теории положено воздействие на циклооксигеназу. Согласно этой теории АСК и другие НПВП вызывают угнетение синтеза простагландинов, что, в свою очередь, запускает серию биохимических реакций, приводящих к развитию приступа бронхиальной астмы [Szczeklik, 1986 г.]. Главную роль в этом процессе играет активация синтеза ЛТB4, ЛТC4 и ЛТE4, которая является результатом прекращения ингибирующего воздействия простагландина (ПГ) E2/ПГI2 и/или гиперпродукции 12–гидропероксиэйкозатетраеновой кислоты [Szczeklik, 1990 г.].
Поскольку аспириновая бронхиальная астма, по всей видимости, является приобретенным заболеванием, она может развиваться на фоне латентной хронической вирусной инфекции, при которой происходит синтез специфических цитотоксических лимфоцитов [Szczeklik, 1990 г.]. Активность этих лимфоцитов ингибирует ПГE2, которые, возможно, синтезируют макрофаги легких.
НПВП блокируют ингибирующий эффект ПГE2, и лимфоциты атакуют и убивают клетки, зараженные вирусом, в результате чего происходит высвобождение токсичных соединений кислорода, лизосомальных ферментов и различных медиаторов воспаления, приводящих к развитию приступов бронхиальной астмы.
В развитии аспириновой бронхиальной астмы также принимают участие тромбоциты. В отличие от тромбоцитов здоровых людей и пациентов, страдающих бронхиальной астмой, но переносящих АСК, тромбоциты пациентов, страдающих аспириновой бронхиальной астмой, после приема АСК и других НПВП синтезируют молекулы, разрушающие клетку [Ameisen и др., 1985 г.]. Однако другие исследователи эти данные не подтвердили [Szczeklik, 1990 г.].
Несмотря на то, что точный механизм развития аспириновой бронхиальной астмы до конца не установлен, по некоторым данным, представленным ниже, ключевую роль в ее развитии играют метаболиты арахидоновой кислоты:
- Астмогенная активность НПВП напрямую связана с их способностью ингибировать циклооксигеназу. Анальгетики, не воздействующие на этот фермент, у пациентов с аспириновой астмой бронхоконстрикцию не вызывают [Szczeklik, 1990 г.].
- Исходные концентрации ЛТE4 в моче пациентов с непереносимостью АСК статистически достоверно выше, чем у пациентов, переносящих АСК. После провокационной аспириновой пробы разница становится более заметной, хотя концентрация тромбоксана B2 в моче не меняется [Christie и др., 1991 г. b; Kumlin и др., 1992 г.; Smith и др., 1992 г.].
- По сравнению с людьми, переносящими АСК, пациенты с аспириновой бронхиальной астмой чрезвычайно чувствительны к ингаляционным ЛТE4, что не наблюдается при ингаляции ЛТC4 [Arm и др., 1989 г.; Vaghi и др., 1985 г.].
- После проведения десенсибилизирующей терапии возрастающими дозами АСК у пациентов отсутствуют реакции на другие НПВП [Bianco и др., 1977 и 1981 г.].
- Антагонисты рецепторов сульфидопептидных лейкотриенов позволяют предотвратить развитие бронхоконстрикции, вызванной АСК [Christie и др., 1991 г.; Dahlen и др., 1992 г.].
- Пациенты с непереносимостью АСК хорошо переносят ингибиторы синтеза тромбоксана A2; они несколько уменьшают бронхоконстрикцию, вызванную АСК [Robushi и др., 1989 г.; Szczeklik и др., 1987 г.].
- Местное введение АСК вызывает статистически достоверное увеличение концентрации пептидных лейкотриенов в назальном секрете, уменьшение концентрации ПГE2 и ПГF2α и не вызывает изменения концентрации ПГD2 [Ferreri и др., 1988 г.; Ortolani и др., 1987 г.; Picado и др., 1992 г.].
Диагностика
В большинстве случаев для постановки диагноза аспириновой бронхиальной астмы достаточно только анамнеза. Если у врача возникают сомнения, проводится пероральная проба с АСК или ингаляционная проба с лизин–аспирином [Bianco и др., 1977, 1981 г.]. Предпочтение отдают ингаляционной пробе, поскольку она является более безопасной и требует меньше времени; в частности, реакции на ингаляцию препарата ограничены бронхиальным деревом и легко купируются ингаляционными β2–адреномиметиками. Кожные провокационные пробы для диагностики аспириновой бронхиальной астмы непригодны, а достоверность хемилюминисцентной пробы с тромбоцитами in vitro, предложенной Ameisen и др. (1985 г.), сомнительна.
НПВП, дающие перекрестную реакцию с АСК
Перечень НПВП, дающих перекрестную реакцию с АСК и провоцирующих развитие симптомов со стороны дыхательной системы у пациентов с аспириновой бронхиальной астмой, представлен в таблице 1. Все эти препараты являются ингибиторами циклооксигеназы; между их ингибирующими свойствами и способностью вызывать развитие бронхиальной астмы имеется прямая, но, тем не менее, гипотетическая связь. Наиболее выраженной способностью к индуцированию бронхиальной астмы обладают ацетилированные салицилаты, индол– и инденуксусная кислоты и арилпропионовые кислоты. Фенаматы, оксикамы и производные пиразолона (пиразолоны, пиразолидиндионы) пациенты переносят лучше. При наличии специфической чувствительности к НПВП чем ярче выражена неспецифическая реактивность бронхов (что наблюдается при отсутствии должного контроля бронхиальной астмы), тем мощнее астматический ответ на НПВП.
Неацетилированные салицилаты, например, салицилат натрия, салициламид и трисалицилат магния холина, а также декстропропоксифен, бензидамин, хлорокин и имидазол– гидроксибензоат пациенты переносят хорошо.
У пациентов с аспириновой бронхиальной астмой фенбуфен может вызывать отсроченную бронхообструкцию. Как правило, она развивается через 3 – 4 ч после приема препарата и сохраняется в течение нескольких часов [Bianco, 1986]. Интересен тот факт, что фенбуфен (3–4– бифенилкарбонил пропионовая кислота) является пролекарством, лишенным антициклооксигеназной активности; такой активностью обладает его основной метаболит – p–бифенилуксусная кислота.
Вероятно, реакция начинается, когда активный метаболит накапливается в бронхах в достаточной концентрации. Подлинность механизма, лежащего в основе двух типов реакций, также подтверждает тот факт, что у пациентов, которым проведена десенсибилизация фенбуфеном, больше не развиваются реакции на АСК и наоборот (наши неопубликованные данные).
Парацетамол является относительно безопасным препаратом: он вызывает астматические реакции только у 5% пациентов, страдающих аспириновой бронхиальной астмой.
Нимесулид
Безопасность другого анилидного производного, нимесулида (4’–нитро–2–феноксиметан сульфонанилид) выше, чем парацетамола (4’– гидрокси ацетанилид). In vitro нимесулид проявляет достаточно низкую антициклооксигеназную активность, однако в связи с наличием выраженного антиоксидантного, антианафилактического и антигистаминного действия [Berti и др., 1991 г.; Magni, 1991] нимесулид является мощным противоспалительным средством.
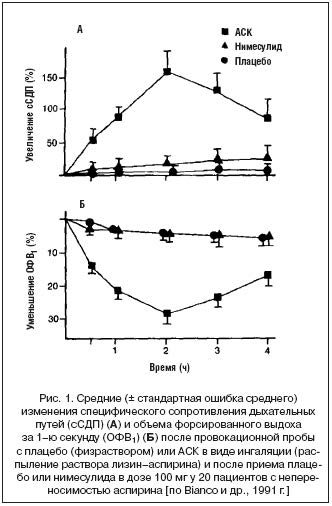
Целью двойного слепого перекрестного исследования, в котором приняли участие 20 взрослых, страдающих аспириновой бронхиальной астмой, было сравнение эффектов нимесулида и плацебо. Все пациенты хорошо перенесли однократную дозу нимесулида 100 мг (отсутствие изменений вентиляции, причиной которых мог стать нимесулид (рис. 1) [Bianco и др., 1991 г.].
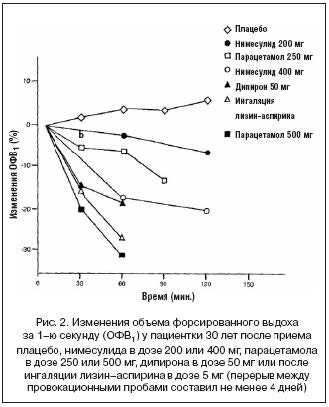
В ходе проведения более позднего исследования 3 пациента с непереносимостью АСК получили препарат в дозе 400 мг (в 4 раза больше рекомендуемой), после чего у них развилась бронхообструкция легкой степени тяжести (легко купирована ингаляционными бронходилататорами). Результаты различных провокационных проб у одного из этих пациентов представлены на рисунке 2. Стоит отметить, что после приема терапевтических доз парацетамола и дипирона у этой женщины, страдающей эндогенной бронхиальной астмой, наблюдалась более выраженная реакция, чем после приема нимесулида.
Таким образом, даже если переносимость нимесулида у пациентов с аспириновой бронхиальной астмой не является 100%–й, нимесулид – это наиболее безопасный препарат среди самых эффективных НПВП.
Действительно, в рекомендуемых дозах нимесулид практически не вызывает нежелательных явлений со стороны дыхательной системы у таких пациентов и может рассматриваться, как новый подход к лечению бронхиальной астмы.
Реферат подготовлен к.м.н. Н.А. Лютовым по материалам статьи S. Bianco, M. Robuschi, G. Petrigni et al. «Efficacy and Tolerability of Nimesulide in Asthmatic Patients Intolerant to Aspirin». Drugs 1993, 46 (Suppl. 1): 115-120 

Литература
- Ameisen JC, Joseph M, Tonnel AB, Fournier H, Wallaert B, et al. Specific abnormal platelet activation in aspirin–sensitive asthma: a basis for an in vitro diagnostic test. Journal of Allergy and Clinical Immunology 75: 123, 1985
- Arm JP, O’Hickey SB. Spur BW, Lee TH. Airway responsiveness to histamine and leukotriene E4 in subjects with aspirin–induced asthma. American Review of Respiratory Disease 140: 148–153, 1989
- Berti F, Rossoni G. Buschi A, Robuschi M, Villa LM. Antiana–phylactic and antihistaminic activity of the nonsteroidal anti–inflammatory compound nimesulide in guinea pig. Arznrim–ittel–Forschung 40: 1011– 1016, 1990
- Bianco S. Asthme et medicaments antiinflammatoires non steroidiens. In S. Charpin (Ed.)
- Atlergologie, 2nd ed. pp. 683–693, Flammarion, Paris, 1986
- Bianco S, Robuschi M, Gambaro G. Spagnotto S, Pctrigni G. Bronchial inflammation and NSAIDs. Drug Investigation 3 (Suppl. 2): 33–33, 1991a
- Bianco S, Robuschi M, Petrigni G. Aspirin– induced tolerance in aspirin asthma detected by a new challenge test, IRCS Journal of Medical Science5: 129, 1977
- Bianco S, Robuschi M, Petrigni G. Aspirin sensitivity in asthmatics. British Medical Journal 282: 116, 1981
- Bianco S, Robuschi M, Vaghi A, Pieroni MG, Refini RM, el al. ASA e patologia respiratoria. In
- E. Ohnmeiss & U. Garagiola (Eds) Acide Acetilsalicilico. Stato attuale e prospettive future, pp. 115–126, Masson, Milano, 1991b
- Ferreri NR, Howland WC, Stevenson DD, Spiegerberg HL. Release of.leukoirienes, prostaglandins and hisiamine inlu nasal secretions of aspirin– sensitive asthmatics during reaction to aspirin. American Review of Respiratory Disease 137: 847–854. 1988 Kumlin M. Dahlen B. Bjorck T. Zetierstrom
- Djukanovic R, Roche WR, Wibon JW, Beasley CRW. Tweniy–man OP, et al. Mucosal inflammation in asthma. American Review of Respiratory Disease 142: 434–457, 1990
- Dahlen B, Kumlin M. Johansson H, Lars-son C, Zetterstrom O, et al. The leukoiriene antagonist MK.–0679 improves pulmonary function and blocks airway obstruction in aspirin–sensitive asthmatics. American Review of Respiratory Disease 145: A15, 1992
- Christie PE, Tagari P, Ford–Hutchinson AW, Charlesson S, Chee Ph, et al. Urinary leukotriene E4 concentration increase after aspirin challenge in aspirin–sensitive asthmatic subjects, American Review of Respiratory Disease 143: 1025–1029, 1991b
- Christie PE, Smith CM, Lee TH, The potent and selective sul–fidopeptide leukotriene antagonist SKF104353 inhibits aspirin–induced asthma. American Review of Respiratory Disease 144; 957–958, 1991a
- O. Granstrom E. ei al. Urinary excretion ofleukotriene E4 and 11 –dehydro– thromboxane B2 in response 10 bionuhial provocation with allergen, aspirin, leukotriene D4 and histamine in asthmatics. American Review of Respiratory Disease 146: 96–103, 1992
- Laitinen LA. Heine M, Laitinen A, Kava T, Haahtela T. Damage of airway epithelium and bronchial reactivity in раисть with asthma. American Review of Respiratory Disease 131: 599606, 1985
- Magni F. Nimesulide. An overview. Drug Investigation 3 (Suppl. 2): 1–3, 1991
- Ortolani C, Mirone C, Fontana A. Fo’co GC, Miadonna A, et al. Study of mediators of anaphylaxis in nasal wash fluids after aspirin and sodium metabisulfite nasal provocation in intolerant rhinitic patients. Annals of Allergy 59: 106–112, 1987>
- Picado C, Ramis I, Rosello J. Prat J. Bulbena O. et al. Release of peptide leukotriene into nasal secretions after local instillation of aspirin in aspirin–sensitive patients. American Review of Respiratory Disease 145: 65–69. 1992
- Robuschi M, Spagnotto S, Gambaro G, Negretto G, Petrigni G et al. Trombossano A2 e reatlivita bronchiate alt’aspirina. Fed erazione Italiana contro la Tubercolosi e le Malattic Polmonari Sociali 59: 81–85, 1989
- Samter M. Beers Jr RF. Intolerance to aspirin. Clinical studies and consideration on its pathogenesis. Annals of Internal Med. icine 68: 957–983, 1968
- Smith CM, Hawksworlh RJ. Thien FCK, Christie PE, Lee TH. Urinary leukoiriene E4 in bronchial asthma. European Respiratory Journal 5: 693– 699, 1992
- Szczeklik A. Analgesics, allergy and asthma. Drugs 32 (Suppl. 4): 148–163. 1986 Szczeklik A. The cyclooxygenase theory of aspirin– induced asthma. European Respiratory Journal 3: 588–593, 1990
- Szczeklik A. Nwankowska E, Dworski R, Splawinski J, Cajewski P, et al. Effects of inhibition of thromboxane A2 synthesis in aspirin–induced asthma. Journal of Allergy and Clinical Immunology 80: 839– 843, 1987
- SzeflerS. Antiinflammatory drugs in the treatment of allergic disease. Medical Clinics of North America 76: 953–975, 1992
- Thomson NC. Antiinflammatory therapies. British Medical Bulletin 48: 205–220, 1992
- Vaghi A, Robuschi M, Simone P, Bianco S. Bronchial responseto leukoiriene C4 in aspirin– asthma. Book of abstracts, p. 171, Sep 4th Congress, Milano–Stresa, 1985
- Van Bever HP, Sievcns WJ. Pharmacotherapy of childhood1 asthma: an inflammatory disease. Drugs 44: 36–46. 1992
Источник
ПАМЯТКА БОЛЬНОМУ, СТРАДАЮЩЕМУ
НЕПЕРЕНОСИМОСТЬЮ НПВС
I. Потивопоказан прием препаратов следующих групп:
1. Анальгетики-антипиретики:
a) производные пиразолона (анальгин, антипирин, пропифеназон) и препараты, содержащие производные пиразолона в своем составе (андипал, анапирин, темпалгин, баралгин, максиган, спазмалгон, триган, саридон и др.).
Необходимо подчеркнуть, что входящий в эту группу амидопирин и содержащие его готовые препараты — пиркофен, пирамеин, реопирин, теофедрин и др. — исключены из номенклатуры в связи с выраженным токсическим действием.
b) парацетамол (ацетаминофен, калпол, тайленол, эффералган, панадол и др.) и комбинированные препараты, содержащие парацетамол (колдрекс, солпадеин, панадеин, панадол-экстра, саридон, цитрамон П, седалгин Н, томапирин и др.);
c) кеторолак (долак, кетанов, кеторал, торадол и др.).
2. Нестероидные противовоспалительные препараты:
a) салицилаты — ацетилсалициловая кислота (аспирин, аспирин Кардио, тромбо АСС, анопирин, астрин, джасприн и др.);
• препараты, содержащие аспирин в своем составе (цитрамон П, асфен, аскофен, кофицил, седальгин Н, аспро С форте, алка-зельтцер, алька-прим, томапирин и др.);
b) бутадион (фенилбутазон, буталан, бутазолидин и др.);
c) другие нестероидные противовоспалительные препараты:
• индометацин (метиндол, индоцид и др.);
• ибупрофен (бруфен, солпафлекс и др.);
• ортофен (диклофенак, вольтарен и др.);
• пироксикам (роксикам, пирокс, пирокам и др.);
• напроксен (апрол, наксен, проксен и др.);
• сулиндак (клинорил и др.);
• кетопрофен (кетонал, остофен, кетоласт и др.);
• мефенамовая кислота (понстел и др.);
• нифлумовая кислота (нифлюран и др.);
d) новые препараты с антипростагландиновым действием (мел оксикам — мовалис, набуметон — рел афен).
II. Не применяются лекарства, содержащие в оболочке краситель тартразин желтый № 5 (аминофиллин, ампициллин, кефлекс, анузол (свечи), аскорбиновая кислота, витамины группы В, бактрим, дульколакс, кодеин, колхицин, метотрексат, налкром, нистатин, преднизолон, тетрациклин, трентал и др.)
III. Не назначаются отвары и настои растений (ива белая, первоцвет, мята, лобазник, тысячелистник, плоды мелиссы, смородины), содержащие природные салицилаты.
IV. Возможно применение с целью обезболивания трамала.
V. Показано соблюдение элиминационной диеты с исключением природных и синтетических салицилатов:
a) фрукты: яблоки, абрикосы, грейпфруты, виноград, лимоны, дыни, апельсины, сливы, персики, нектарины;
b) ягоды: красная и черная смородина, вишня, ежевика, крыжовник, малина, земляника, клубника, клюква;
c) овощи: огурцы, перец, помидоры, картофель;
d) смешанная группа: миндальный орех, изюм, вино и винный уксус, сидр и яблочный уксус, мятные конфеты, напитки из корнеплодов, газированные напитки.
VI. Исключаются продукты, окрашенные тартразином или содержащие консерванты, применяемые в пищевой промышленности и подобные по действию аспирину: желе, икра, маргарин, сливочное масло, мороженое, пудинги, сыры, окрашенные булочные изделия; все консервы, в том числе фруктовые, все гастрономические изделия (колбасы, ветчина, буженина), торты и пирожные с кремами желтого цвета, фруктовые воды, конфеты — карамель, мармелад и драже.
Медицинский центр АМБН
www.ambn.ru
Источник
Противовоспалительные
средства —
лекарственные средства, подавляющие воспалительный процесс, препятствуя
мобилизации или трансформации арахидоновой кислоты. К П. с. не относят
средства, способные влиять на воспалительный процесс посредством иных
механизмов, в частности цитостатики, «базисные» противоревматические препараты
(соли золота, Д-пеницилламин, сульфасалазин), противоподагрические средства
(колхицин), хинолиновые производные (хлорохин).
   Различают две
основные группы П. с.: глюкокортикостероиды и нестероидные
противовоспалительные средства.
   Глюкокортикостероиды (глюкокортикоиды) — естественные или
синтетические гормоны коркового вещества надпочечников — имеют наиболее
универсальный механизм противовоспалительной активности. Он связан с их
способностью активировать синтез липокортина — белка, который
предотвращает мобилизацию арахидоновой кислоты из мембранных фосфолипидов путем
подавления РёС… гидролиза фосфолипазой A2. Рто РїСЂРёРІРѕРґРёС‚ Рє уменьшению
синтеза эйкозаноидов: простациклина, тромбоксана, лейкотриенов, играющих
ведущую роль в развитии воспаления.
   Показанием к
применению глюкокортикостероидов в качестве П. с. являются преимущественно
патоиммунное воспаление. Они широко используются в острой фазе системных болезней соединительной
ткани, артритов, саркоидоза, альвеолитов, неинфекционных воспалительных
заболеваний кожи.
   С учетом влияния
глюкокортикостероидов на многие функции организма (см. Кортикостероидные гормоны) и
возможного формирования зависимости течения ряда забоелваний (бронхиальная
астма и др.) от регулярности использования этих препаратов (опасные проявления
отмены) к их назначению в качестве П. с. относятся с определенной осторожностью
и стремятся сократить продолжительность
их непрерывного применения. С другой стороны, среди всех П. с.
глюкокортикостероиды обладают наиболее выраженным противовоспалительным
эффектом, поэтому прямым показанием к их использованию является локализация
воспалительного процесса, опасная для жизни или трудоспособности больного (в
ц.н.с., в проводящей системе сердца, в глазах и т.п.).
   Побочные действия
глюкокортикостероидов зависят от их суточной дозы, длительности применения,
способа введения (местное, системное лечение), а также от свойств самого
препарата (выраженность минералокортикоидной активности, влияния на жировой
обмен и т.д.). При местном их применении возможно локальное снижение
резистентности к инфекционным агентам с развитием местных инфекционных
осложнений. При системном использовании глюкокортикостероидов возможны синдром Кушинга, стероидный диабет, стероидная язва желудка,
стероидный васкулит, развитие остеопороза, гипертрихоз, задержка натрия и воды,
потеря калия, артериальная гипертензия, миокардиодистрофия, инфекционные
осложнения (в первую очередь туберкулез), развитие психоза, синдром отмены при
ряде заболеваний (резкое обострение симптомов после прекращения лечения),
недостаточность функции надпочечников (после длительного применения
глюкокортикостероидов).
   Противопоказания к системному применению
глюкокортикостероидов: туберкулез и другие инфекционные заболевания, сахарный
диабет, остеопороз (в т.ч. в постклимактерический период), язвенная болезнь
желудка и 12-перстной кишки, артериальная гипертензия, склонность к тромбозу,
нарушения психики, беременность. При их местном применении (кожа, дыхательные
пути, суставы) основным противопоказанием является наличие в этой же области
тела инфекционного процесса.
   Основные формы
выпуска глюкокортикостероидов, используемых в качестве П. с., приведены ниже.
   Бекламетазон — дозированный порошок
(бекломет-изихейлер) и дозированный аэрозоль для ингаляций при бронхиальной
астме (альдецин, беклазон, бекломет, беклокорт, беклофорт, бекотид) или для
интраназального применения при аллергическом рините (беконазе, насобек) по
0,05, 0,1 Рё 0,25 РјРі РІ РѕРґРЅРѕР№
РґРѕР·Рµ. РџСЂРё бронхиальной астме суточнаяВ
доза колеблется в пределах 0,2—0,8 мг. Для предупреждения развития кандидоза ротовой полости и верхних
дыхательных путей рекомендуется полоскание полости рта водой после каждой
ингаляции препарата. В начале лечения иногда появляется осиплость, першение в
горле, кашель, которые обычно проходят в течение первой недели.
   Бетаметазон (целестон) — таблетки
по 0,5 мг и раствор в ампулах по
1 мл (4 мг) для внутривенного, внутрисуставного,
субконъюнктивального введения; депо-форма (препарат «дипроспан») —
раствор в ампулах по 1 мл
(2 мг бетаметазона динатрия
фосфата и 5 мг медленно
абсорбирующегося бетаметазона дипропионата) для внутримышечного и внутрисуставного введения.
   Для накожного
применения — кремы и мазь в тубах под названиями «Бетновейт»
(0,1%), «Дипролен» (0,05%), «Кутерид» (0,05%), «Целестодерм»
(0,1%).
   Будесонид (будесонид мите, будесонид
форте, пульмикорт) — дозированные аэрозоли по 0,05 и 0,2 мг в одной дозе, а также дозированный
порошок по 0,2 мг (пульмикорт
турбухалер) для ингаляций при бронхиальной астме (терапевтическая доза
0,2—0,8 мг/сут); 0,025% мазь («апулеин»)
для наружного применения при атопическом дерматите, экземе, псориазе
(1—2 раза в сут наносится тонким слоем на пораженные участки кожи).
   Гидрокортизон (солу-кортеф, сополькорт
Н) — суспензия для инъекций по 5 мл
во флаконах (25 мг в 1 мл), а также раствор для инъекций в
ампулах по 1 мл (25 мг) и лиофилизированный порошок для
инъекций по 100 мг с прилагаемым
растворителем. Р
Источник