Астма у детей с блд
Дискуссионным до сих пор является вопрос об отношении бронхиальной астмы (БА) и бронхолегочной дисплазии (БЛД). С одной стороны, имеются указания на высокую частоту БА в семейном анамнезе у детей с развившейся БЛД, в том числе и в особенности у пациентов с тяжелой БЛД, описывается трансформация БЛД в БА [1—3]. Бронхиальная астма в семейном анамнезе является фактором тяжелого течения БЛД [2]. Действительно, наличие бронхиальной гиперреактивности позволяет отнести детей с БЛД к группе риска по развитию БА [2, 4]. C другой стороны, БЛД, согласно рекомендациям Национальной программы
«Бронхиальная астма у детей» (2012) и Глобальной стратегии лечения и профилактики бронхиальной астмы GINА (2014), включена в группу заболеваний, с которыми проводится дифференциальный диагноз при подозрении на БА у детей [5, 6].
Имеются наблюдения, свидетельствующие, что дети, перенесшие БЛД, подвержены возникновению аллергических заболеваний, в том числе БА, не чаще, чем их здоровые сверстники [7]. Мало изученным остается вопрос о частоте и особенностях БА у детей, рожденных преждевременно, в том числе страдающих БЛД [8]. Исследователи до сих пор не пришли к единому мнению, может ли БА быть респираторным исходом БЛД или является коморбидным заболеванием. Описанная частота развития БА у детей с БЛД как в России, так и мире имеет сильную вариативность, от 0 до 51,6% [9—13]. Клиническую картину, особенности течения заболеваний, тактику ведения данной категории пациентов и терапию при одномоментном наличии БА и БЛД во всем мире изучают мало, ограничиваясь нередко единичными клиническими наблюдениями [14, 15].
Представляем два клинических наблюдения БА у детей с БЛД, наблюдавшихся и проходивших обследование в консультативнодиагностическом отделении с дневным стационаром (КДО с ДС) ДИКБ № 6 и МДГКБ Департамента здравоохранения г. Москвы.
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ 1
Девочка Н., 6 лет (09.09.2011 г.р.) наблюдалась в КДО с ДС ДИКБ № 6 по поводу БЛД. Ребенок от женщины 27 лет с отягощенным акушерско-гинекологическим анамнезом (поликистоз яичников, истмико-цервикальная недостаточность, бесплодие) от 1 беременности, протекавшей с угрозой прерывания в I триместре, на фоне экстракорпорального оплодотворения. Роды самостоятельные, преждевременные на 26 нед. Масса тела при рождении 970 г, длина 36 см, оценка по шкале Апгар 4/6 баллов. Состояние при рождении тяжелое за счет дыхательной недостаточности, инфекционного токсикоза. Интубирована в родильном зале, с рождения на ИВЛ с жесткими параметрами. Вводился куросурф. Девочка после рождения длительно (2 мес 29 дней) находилась на искусственной вентиляции легких (ИВЛ), сформировала тяжелую БЛД. В неонатальном периоде перенесла генерализованную инфекцию (пневмонию, энтероколит, инфекцию мочевой системы), находилась на стационарном лечении в отделении патологии новорожденных с 09.09 по 14.02.2012 (рис. 1).
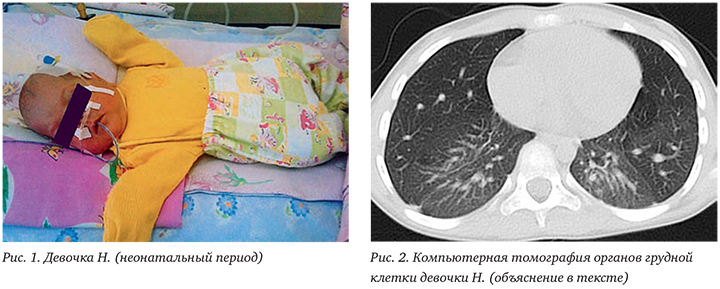
До 1 года получала кислородотерапию на дому с помощью концентратора кислорода. С рождения до 3 лет нуждалась в постоянной терапии ингаляционными глюкокортикостероидами (ИГКС) и бронхолитическими препаратами. При неоднократных попытках снижения дозы ИГКС отмечалось резкое нарастание бронхообструктивного синдрома (БОС) и дыхательной недостаточности.
Госпитализировалась в ДИКБ № 6 с 19.02 по 20.02.2012 с ОРЗ, сопровождавшимся нетяжелым обострением БЛД.
В эпидсезон 2013—2014 гг. получила иммунизацию паливизумабом (5 введений).
Проведены обследования. Эхокардиография (ЭхоКГ) от 14.02.2014: расчетное давление в легочной артерии 35/6 мм рт.ст. (норма 30/10 мм рт.ст.), открытое овальное окно 3 мм. Дополнительная трабекула левого желудочка.
Рентгенография органов грудной клетки от 21.01.2014: выраженная гиперинфляция легких, пневматизация неравномерна (чередование буллезных вздутий и лентообразных уплотнений), легочный рисунок обогащен, деформирован, вилочковая железа умеренно расширена вправо, очаговоинфильтративные изменения не определяются, синусы свободны.
По данным компьютерной томографии (КТ) органов грудной клетки от 17.02.2014: КТкартина явлений пневмофиброза с сопутствующими небольшими участками неоднородности пневматизации (рис. 2).
У девочки, начиная с двух лет жизни, в весенний период отмечались явления ринита и конъюнктивита без повышения температуры тела (аллергический риноконъюнктивит). Семейный анамнез отягощен: у отца аллергический риноконъюнктивит на домашних животных (морская свинка, кошка).
С весны 2014 г. появились жалобы на ежемесячные эпизоды БОС, несмотря на продолжающуюся непрерывно ингаляционную терапию, последний эпизод в январе 2015 г. Кашель провоцируют физическая активность, холодный воздух.
Сохранение повторных эпизодов бронхиальной обструкции, ежедневное подкашливание, кашель и одышка при физической нагрузке, сохранение потребности в ежедневной ингаляционной терапии у недоношенного ребенка с БЛД в анамнезе требовали исключения БА. Ребенок был обследован: в общем анализе крови эозинофилия до 11%; в аллергологическом статусе повышение уровня общего IgE до 75 МЕ/мл при норме до 50 МЕ/мл. Обнаружено повышение уровня специфических IgE к пищевым и бытовым аллергенам — умеренная аллергическая реакция на курицу, куриное яйцо, мандарин, шоколад, D. рteronissimus.
 По совокупности критериев (отягощенный личный аллергоанамнез — аллергический риноконъюнктивит, кашель при физической активности, ежемесячные эпизоды БОС, повышение уровня общего IgE и специфических IgE к пищевым аллергенам и домашней пыли, ежедневная потребность в ингаляциях бронхолитических препаратов и положительный эффект от назначения бронхолитической терапии) позволили диагностировать атопическую БА. Была назначена базисная терапия флутиказоном пропионатом 200 мкг/сут, монтелукастом 4 мг/сут.
По совокупности критериев (отягощенный личный аллергоанамнез — аллергический риноконъюнктивит, кашель при физической активности, ежемесячные эпизоды БОС, повышение уровня общего IgE и специфических IgE к пищевым аллергенам и домашней пыли, ежедневная потребность в ингаляциях бронхолитических препаратов и положительный эффект от назначения бронхолитической терапии) позволили диагностировать атопическую БА. Была назначена базисная терапия флутиказоном пропионатом 200 мкг/сут, монтелукастом 4 мг/сут.
На фоне лечения отмечалось значительное улучшение самочувствия ребенка, снижение потребности в бронхолитических препаратах, регресс кашля, провоцируемого физической активностью, улучшение переносимости физических нагрузок (рис. 3).
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ 2
Мальчик И., 12 лет (31.03.2005 г.р.) наблюдался на кафедре педиатрии РУДН, в КДО с ДС ДИКБ № 6, МДГКБ по поводу БЛД.
Ребенок от 1 беременности, протекавшей с токсикозом в I триместре, угрозой прерывания во II, эклампсией. На сроке 24 нед в мазках из влагалища обнаружена уреаплазма. По данным УЗИ плода на сроке 33 нед диагностирована задержка внутриутробного развития плода (ЗВУР) по ассиметричному типу, нарушение маточного кровотока 1 степени.
Роды преждевременные на 33—34 нед путем кесарева сечения. Воды светлые. Оценка по шкале Апгар 6—8 баллов. Масса тела при рождении 1900 г, длина 44 см, окружность головы 32 см, окружность груди 27 см. Состояние при рождении тяжелое за счет РДС новорожденных, в связи с чем ребенок был помещен на ИВЛ. Проводилась антибиотикотерапия, посиндромная терапия.
В возрасте 5 дней для дальнейшего лечения ребенок был переведен в отделение реанимации с диагнозом «болезнь гиалиновых мембран, церебральная ишемия 2—3 степени, недоношенность 33—34 нед, морфофункциональная незрелость, ЗВУР». Получал лечение: аксетин+гентамицин 3 дня, фортум+эдицин 9 дней, тиенам 8 дней; переливание эритроцитарной массы № 2, дексаметазон 2 курса по 7 дней, лазикс, эуфиллин, ИВЛ 20 сут. На фоне проводимого лечения состояние нормализовалось.
В возрасте 25 сут жизни ребенок был переведен в отделение патологии новорожденных с диагнозом «БЛД, двухсторонняя пневмония, церебральная ишемия 2—3 степени, недоношенность 33—34 нед». Состояние ребенка оставалось тяжелым за счет дыхательной недостаточности, токсикоза в результате течения двухсторонней пневмонии на фоне БЛД, неврологической симптоматики в виде угнетения нервно-рефлекторной деятельности. При проведении ЭхоКГ данных за врожденный порок сердца получено не было, выявлена легочная гипертензия 1 степени, диастолическая дисфункция миокарда правого желудочка. Получал лечение: максипим+амикацин 10 дней, флюконазол, азитромицин, ингаляции с эуфиллином, фликсотид, верошпирон. Для дальнейшего ведения ребенок был переведен на второй этап выхаживания. Сохранялась кислородозависимость: вне кувеза с увлажненным О2 отмечался генерализованный цианоз, ЧД 50—70 дыхательных движений в минуту, в дыхании участвовала дыхательная мускулатура. При аускультации на фоне ослабленного дыхания выслушивались двухсторонние влажные разнокалиберные хрипы, рассеянные сухие хрипы. Тоны сердца достаточной звучности, ритмичные. ЧСС 140—160 ударов в минуту.
При проведении КТ легких (14.06.2005) отмечалась выраженная деформация легочного рисунка по нодозно-ретикулярному типу за счет соединительнотканного компонента. Стенки сегментарных бронхов утолщены, уплотнены. На всем протяжении легочных полей, преимущественно в дорсальных отделах, больше справа, отмечались множественные линейные лентообразные уплотнения (участки фиброза), чередующиеся с зонами просветления за счет эмфиземы.
Получал лечение: нетромицин, меронем, флюконазол, эритростим, будесонид и фенотерол+ипратропия бромид через небулайзер, преднизолон в/м, аспаркам, люминал, циннаризин, мальтофер, корилип, элькар, кудесан, танакан, эмоксипин.
Ребенок был выписан домой с рекомендациями проведения длительной кислородотерапии и ингаляций будесонида. Находился на домашней кислородотерапии с помощью концентратора кислорода до 10 мес.
Наблюдался пульмонологом с первого года жизни. На первом году жизни SatО2 сохранялась не ниже 92% при режиме О2-терапии не менее 16 ч в сутки, тахипноэ до 55 вдохов в минуту в покое и до 68 при беспокойстве, наблюдались вздутие грудной клетки, втяжение межреберий в покое, периоральный цианоз. В легких определялось умеренно ослабленное дыхание, непостоянные сухие свистящие хрипы. Была продолжена ингаляционная терапия будесонидом в эффективных дозах, через 6 мес потребность в кислороде снизилась до 4 ч в сутки, SatО2 увеличилась до 98%; находясь на данной терапии, мальчик повторно госпитализировался по поводу ОРВИ, обострения БЛД, потребовавшей применения бронхолитиков.
В дальнейшем у ребенка отмечались периодические жалобы на кашель, обструктивные бронхиты, одышку; потребность в ингаляциях бронхолитиков была практически ежедневной. Усиление БОС с сопутствующими проявлениями АР отмечалось на даче в мае на протяжении 1-го и 4-го классов школы.
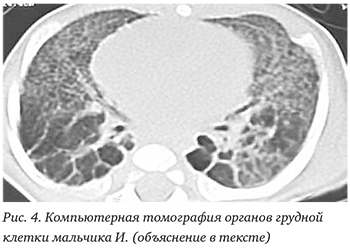
 При повторном проведении КТ легких (29.08.2012) отмечена картина эмфиземы легких, облитерирующего бронхиолита в исходе БЛД: пневматизация долей и сегментов неравномерная, легочный рисунок усилен, деформирован; на фоне выраженного пневмофиброза (линейного фиброза, идущего от корня к периферии легких) определялись множественные буллезные вздутия максимальными размерами в базальных отделах до 38×27 мм; бронхи прослеживались до субсегментарных ветвей, просвет бронхов не расширен, стенки уплотнены; просвет трахеи и главных бронхов не изменен (рис. 4).
При повторном проведении КТ легких (29.08.2012) отмечена картина эмфиземы легких, облитерирующего бронхиолита в исходе БЛД: пневматизация долей и сегментов неравномерная, легочный рисунок усилен, деформирован; на фоне выраженного пневмофиброза (линейного фиброза, идущего от корня к периферии легких) определялись множественные буллезные вздутия максимальными размерами в базальных отделах до 38×27 мм; бронхи прослеживались до субсегментарных ветвей, просвет бронхов не расширен, стенки уплотнены; просвет трахеи и главных бронхов не изменен (рис. 4).
У недоношенного ребенка с БЛД с учетом частых эпизодов БОС, их сезонного характера (весна), сопутствующего АР, ежедневной потребности в ингаляциях бронхолитических препаратов требовалось исключение бронхиальной астмы.
При проведении аллергологического обследования выявлено повышение уровня сывороточного общего IgE (210 МЕ/мл при норме до 50 МЕ/мл), специфических IgE к пищевым, пыльцевым, бытовым и грибковым аллергенам:
- очень высокий уровень IgE (++++) к аллергенам говядины, индейки, судаку, коровьему молоку, домашней пыли; высокий уровень IgE (+++) к аллергенам свинины, кролика, трески, ржаной и пшеничной муки, апельсина, мандарина, картофеля, болгарского перца, меда, шерсти овцы, полиамидному и ацетатному волокну, D. farina;
- умеренная аллергическая реакция (++) на куриное яйцо, овсяную муку, виноград, клубнику, томат, белокочанную капусту, морковь, какао, шоколад, микст пыльцы деревьев, ольху, амброзию, тимофеевку, перо подушки и попугая, Alternaria tenuis, Aspergillus flavus.
Ребенку проводилось выявляющее обструктивные нарушения исследование функции внешнего дыхания (ФВД), а также проба с бронхолитиком. При проведении спирометрии выявлены обструктивные нарушения; при проведении пробы с бронхолитиком (сальбутамол) выявлен прирост объема форсированного выдоха за первую секунду (ОФВ1) на 25% (270 мл), проба расценена как положительная. У мальчика на основании данных анамнеза, дополнительных методов исследования была диагностирована атопическая БА, назначена базисная терапия флутиказоном пропионатом+сальметеролом 50/25 мкг по 2 вдоха утром и вечером и монтелукастом (5 мг/сут). На фоне лечения была отмечена положительная динамика в виде уменьшения приступов бронхиальной обструкции и выраженности одышки.
Ребенку повторно проводились исследования ФВД в динамике на фоне проводимой терапии (табл.).
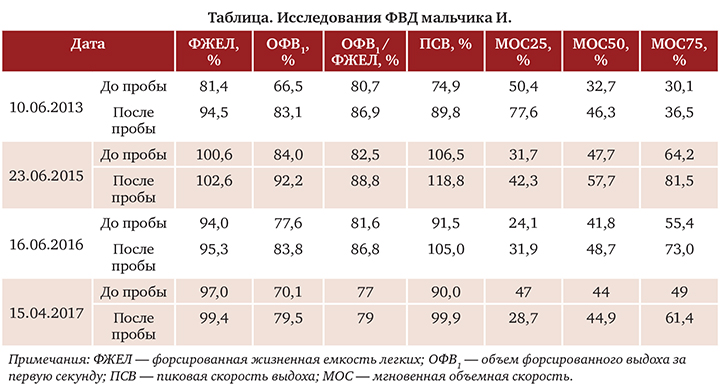
При проведении повторных проб с бронхолитиком в динамике на фоне базисной терапии БА были получены следующие результаты, демонстрирующие снижение обратимости бронхиальной обструкции:
- от 10.06.2013 (8 лет): прирост ОФВ1 25% (270 мл) в пробе с сальбутамолом;
- от 17.10.2013 (8 лет): прирост ОФВ1 3,6% (50 мл) в пробе с сальбутамолом;
- от 14.05.2014 (9 лет): прирост ОФВ1 9% (180 мл) в пробе с сальбутамолом;
- от 13.03.2015 (9 лет): прирост ОФВ1 13% (170мл)впробесфенотеролом+ипратропия бромидом;
- от 02.06.2015 (10 лет): прирост ОФВ1 13% (190мл) впробесфенотеролом+ипратропия бромидом.
В настоящее время продолжена базисная терапия салметеролом+флутиказоном 25/50, 2 вдох (утром), 1 вдох (вечером) и монтелукастом (5 мг/сут) с положительным клиническим эффектом в виде уменьшения приступов бронхиальной обструкции и выраженности одышки.
Данные клинические наблюдения демонстрируют возможность одновременного наличия у одного пациента БА и БЛД (во втором наблюдении в сочетании с облитерирующим бронхиолитом). Диагностировать БА у ребенка с БЛД позволяют тщательный сбор анамнеза, обнаруживающий БА в семейном анамнезе; наличие БОС, сопутствующих аллергических заболеваний, эозинофилии периферической крови; выявление сенсибилизации к аллергенам, в большей степени к ингаляционным, обратимой бронхиальной обструкции при исследовании ФВД и проведении пробы с бронхолитиком.
- Nickerson B.G. Family history of asthma in infants with bronchopulmonary dysplasia. Pediatrics. 1980; 65:1140.
- Овсянников Д.Ю. Бронхолегочная дисплазия: от Норсвея до наших дней / Д.Ю. Овсянников, Е.В. Бойцова, И.В. Давыдова, Е.А. Дегтярева, С.Д. Ахвледиани; под ред. Д.Ю. Овсянникова. М., 2016. 384 с.
- Кузьмина Т.Б. Прогнозирование бронхолегочных заболеваний в раннем возрасте у детей, находившихся на искусственной вентиляции легких в неонатальном периоде: автореф. дис. … к.м.н.: 14.01.08. Кузьмина Татьяна Будажаповна. М., 1996. 24 с.
- Балаболкин И.И. Бронхиальная астма у детей. И.И. Балаболкин, В.А. Булгакова. М., 2015. 144 с.
- Национальная программа «Бронхиальная астма у детей. Стратегия лечения и профилактика». 5-е изд., перераб. и доп. М., 2017.160 с.
- Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention.
- Vrijlandt E.J. Gender differences in respiratory symptoms in 19-year-old adults born preterm / E.J. Vrijlandt, J. Gerristen, H.M. Boezen et al. Respir. Res. 2005;6:117.
- Joshi S. Exerciseinduced bronchoconstriction in school-aged children who had chronic lung disease in infancy. S. Joshi, T. Powell, W.J. Watkins, M. Drayton et al. J Pediatr. 2013;162: 813—818.
- Запевалова Е.Ю. Клиническое течение и структурные изменения легочной ткани у детей с бронхолегочной дисплазией в анамнезе
- Пятеркина О. Г. Течение и исходы бронхолегочной дисплазии у детей в Республике Татарстан (Сборник трудов конгресса. XIX Национальный конгресс по болезням органов дыхания). О.Г. Пятеркина, Д.С. Шагиахметова, Л.В. Храмова и др.; под ред. А.Г. Чучалина. М., 2009. С. 95.
- Cazzato S. Lung function outcome at school age in very low birth weight children. S.Cazzato, L. Ridolfi, F. Bernardi, G. Faldella, L. Bertelli. Pediatr Pulmonol. 2013;48:830—837.
- Hung Y.L. Very low birth weight infants with bronchopulmonary dysplasia have higher risk to develop childhood asthma. Y.L. Hung, W.S. Hsieh, H.C. Chou, Y.H. Yang et al. Clinical Neonatology. 2005;12(2): 45—50.
- Ünal S. Wheezing, asthma, and atopy in premature infants at 2 years of age / S. Ünal, A. Kaya, L. Bilgin, E. Misirlioğlu et al. Med Sci. 2017;47(2):607—613.
- Шабалов Н.П. Неонатология. Т. 1. Н.П. Шабалов. М., 2004. 608 с.
- Cutz E. Chronic lung disease after premature birth. E. Cutz, D. Chiasson. The New England Journal of Medicine. 2008;358(7):743.
Источник
Организм новорожденного сильно уязвим, особенно у недоношенных. Органы и системы детей, появившихся раньше срока, отличаются морфологической незрелостью. При нарушении функции дыхания и газообмена прибегают к искусственной вентиляции легких (ИВЛ).
Вследствие некомпетентности, неорганизованности медицинских работников во время выполнения ИВЛ у грудничков развивается бронхолегочная дисплазия (БДЛ). Общий показатель смертности при повреждении тканей нижних дыхательных путей – 10-25%. У выживших сохраняются морфологические изменения альвеол.
Что такое бронхолегочная дисплазия
В ранний постнатальный период в организме преждевременно рожденных плохо развита реакция на раздражители. Взаимодействие между разными системами не налажено. Пневмотаксический центр, находящийся в головном мозге и обеспечивающий правильное чередование вдоха и выдоха, сформирован не до конца. Дыхание неравномерное, прерывается респираторными паузами. Детям, недавно появившимся на свет, с массой тела ниже 1500 г, нередко требуется кислородная терапия. При неправильном расчете концентрации кислорода во время проведении аппаратной вентиляции возникает бронхолегочная дисплазия.
После постановки диагноза оповещают мать маленького пациента. Чтобы понять, что угрожает ребенку, следует разобраться, что такое бронхолегочная дисплазия. Патология относится к поздним патологическим изменениям, развивающимся у детей в результате длительной нерациональной аппаратной вентиляции легких.
Патология относится к ятрогенным – развивается вследствие безалаберности медсестер, докторов при выполнении ИВЛ. Недоношенные дети нуждаются в специальном уходе. Малышам с проблемами дыхания проводят аппаратную вентиляцию с высокими концентрациями кислорода.
Для новорожденных применяется метод ИВЛ с ограничением давления: вдох заканчивается в момент, когда давление достигает заданного максимального параметра. Поток распределяется относительно равномерно, а метод считается более безопасным.
Аппаратная вентиляция легких требует пристального наблюдения за состоянием маленького пациента и точного расчета кислорода и давления. Следует учитывать растяжимость легких. Установка подбирается индивидуально, врач не менее часа находится у юовеза, следит за дыханием, оптимизируя вентиляцию.
В условиях обычных стационаров расчет давления проходит по одной формуле без учета индивидуальных особенностей. В результате избыток кислорода приводит к деструкции.
Почему возникает у недоношенных детей
Анатомически легкие состоят из бронхов, заканчивающихся бронхиолами с альвеолами на концах. Последние представляют собой воздушные пузырьки, покрытые множеством кровеносных сосудов. При вдохе пузырьки расширяются, при выдохе – уменьшаются, а находящийся внутри кислород переходит в кровь, CO₂ удаляется обратно. Альвеолы покрыты сурфактантом, не дающим пузырькам слипаться и меняющим их натяжение в зависимости от того, вдох это или выдох.
Сурфактант вырабатывается начиная с 26 недели беременности. Дети, рожденные в период с 28 по 38 неделю гестационного периода, испытывают недостаток поверхностного вещества и проблемы с дыханием. Для восстановления легочной функции пациентам назначают медикаментозную и кислородную терапию.
Недоношенные дети, родившиеся в гестационным возрасте от 23 до 30 недель – во время канальцевой и саккулярной стадии развития легкого, подвергаются наибольшему риску возникновения БЛД.
На развитие бронхолегочной дисплазии у недоношенных детей влияет ряд факторов:
1. Механическая травма. Незрелые легкие трудно проветривать из-за дефицита сурфактанта. При недостатке поверхностного вещества ухудшается растяжимость дыхательных органов, развиваются проблемы с функциональной остаточной способностью. При вентиляции легкие расширяются неравномерно с очаговыми перенапряжениями и ателектазом (спадения доли). Положительное давление и избыточный объем при проведении вентиляции приводят к чрезмерному надуванию легкого, повреждению клеток, воспалению.
2. Кислородная токсичность. Супрафизиологический кислород приводит к увеличению генерации митохондриальных активных форм О₂. Вследствие дефицита антиоксидантов и незрелой защиты повышается восприимчивость к окислительному стрессу и повреждению альвеолярных клеток в развивающемся легком.
3. Инфекция и воспаление. Кроме всего прочего, у преждевременно родившегося ребенка не сформирован иммунитет. Постнатальные воспаления, внутрибольничная инфекция ухудшают функции дыхательного органа. Часто у малышей, получавших в первую неделю жизни курсы антибиотиков, развивается резистентность грамотрицательных бактерий. В результате сложно подобрать медикамент и развивается более тяжелая инфекция, поражающая ткани органов дыхания.
4. Генетика. У малышей, преждевременно появившихся на свет, гены антиоксидантов (каталаза, SOD, глутатионпероксидаза), обеспечивающие защиту против активных форм кислорода, обладают низкой активностью. Кислород активизирует другие гены, ответственные за синтез противовоспалительных цитокинов, что приводит к увелечению нейрофилов.
У недоношенных новорожденных легкие часто подвергаются нескольким источникам травм как до, так и после рождения. Эти воздействия, наряду с генетической предрасположенностью к патологиям легких, могут вызвать прямое повреждение паренхимы дыхательных органов с последующим отклонением от нормального пути развития.
Классификация
В неонатологии уделяют две основные формы БЛД:
1. Классическая («тяжелая») – развивается у новорожденных, к которым применялись жесткие режимы аппаратной вентиляции, без заменительной сурфактатной терапии.
2. Новая (постсурфактантная) – возникает у детей гестационного возраста 28-32 недели, которым вводился сурфактант.
В отечественной неонатологии классификация бронхолегочной дисплазии определяется степенью тяжести патологии:
· легкая – дыхание комнатное до 56 дня постнатального возраста;
· умеренная – приступы тахиапноэ, при плаче, кормлении. Необходима распираторная поддержка;
· тяжелая – требуется проведение вентиляции с положительным давлением и концентрацией кислорода >30%.
Классическая форма
Представляет собой тяжелую хроническую форму заболевания легких, возникающее после респираторно-депрессивного синдрома до введения сурфактанта. Данная форма бронхолегочная дисплазия наблюдается у детей любого гестационного возраста. Патогенетические факторы: респираторная недостаточность, требующая ИВЛ, неонатальная пневмония, гипоплазия легких, синдром аспирации мекония.
Форма чаще встречается у мальчиков и обратно пропорционально связана с тем, сколько было недель при рождении и каков был вес. Патология характеризуется повышенным сопротивлением дыхательных путей при воспалении и гиперчувствительностью бронхов. Течение часто осложняется патологиями инфекционного генезиса с последующим развитием нарушения газообмена в органах дыхательной системы и крови.
Патологические признаки классической формы:
· чередование ателектаза с гиперинфляцией легких;
· тяжелые эпителиальные поражения дыхательных путей: антенотальное недоразвитие, сквамозные изменения эпителия;
· выраженная недоразвитость структурных элементов гладких мышц легких;
· обширная, диффузная фибропролиферация;
· гипертрофирование легочных артерий;
· снижение альвеоляризации и площади поверхности.
По статистике при тяжелой форме БЛД выживаемость составляет 71-81%.
Новая форма
Чаще всего возникает у малышей, рожденных на 24-28 неделях гестационного периода, с массой тела от 400 г до одного килограмма. Основные факторы, влияющие на развитие: морфологическая незрелость легких, нарушение развития паренхимы, «воздушных пузырьков» и сосудов легочного ствола.
Дети с новой формой бронхолегочной дисплазии в первые несколько суток жизни испытывают незначительную потребность в О₂. И только спустя несколько недель функции легких ухудшаются, характеризуется нарушениями газообмена.
Патологические признаки новой формы:
· менее регионарная гетерогенность заболеваний легких;
· редкие эпителиальные поражения органов дыхания;
· мягкое утолщение гладких мышц легких;
· небольшие изменения фибропролиферации;
· наличие небольшого числа «дисморфных» артерий.
При ухудшении на рентгенографии наблюдается «туманность» легких, что свидетельствует о повышении альвеолярно-капиллярной проницаемости.
Симптомы у новорожденных
БЛД не отличается специфической клинической картиной. Первые проявления такие же, как и при респираторном дистресс синдроме (РДС). Симптомы бронхолегочная дисплазия у новорожденных:
· нарушение нормального газообмена, обусловленное высокими дозами кислорода, подаваемого длительное время во время аппаратной вентиляции;
· медиастинальная эмфизема;
· скопление газа в плевральной полости, которое ведет к спадению легкого;
· приступы апноэ;
· аритмия с ЧСС менее 60 уд./мин.
Из визуальных признаков – грудная клетка увеличивается в размерах, похожа на бочку.
Клинические рекомендации по защите легких от повреждения
Поскольку патогенез заболевания многофакторный применяются разнообразные подходы, направленные на защиту от повреждений легких и развития БЛД.
При терапии бронхолегочной дисплазия у детей придерживаются клинических рекомендаций, которые доказали свою эффективность.
1. Стратегия проведения ИВЛ. Для снижения вероятности травматизации дыхательных органов проводится «мягкая вентиляция» – минимальная либерализация мишеней СО₂ (>52 против <48 мм рт. ст). Эффективно использование неинвазивных методов вентиляции с положительным давлением, двухуровневой назальной и носовой канюлей с высоким расходом.
2. Экзогенный сурфактант. Заменительная терапия с применением активного поверхностного вещества животного происхождения снижает частоту скопления воздуха в плевральной полости, улучшает оксигенацию.
3. Применение кортикостероидов. Глюкокортикоиды снижают частоту развития патологии за счет уменьшения воспаления, а также индукции изменения созревания легких. Для уменьшения негативного воздействия гормональных препаратов на неокрепшую нервную систему применяют эндотрахеальный будесонид с сурфактантом.
4. Кофеин. Использование вещества позволяет снизить продолжительность аппаратной вентиляции. Вещество широко используется при терапии апноэ. Единственный побочный эффект – снижение весовых прибавок.
5. Витамин А. Ретинол играет важную роль в поддержании целостности эпителия дыхательных путей и является ключевым регулятором нормального роста легких. Препарат вводится внутримышечно, что связано с дискомфортом и повышенным риском инфицирования.
Последствия и прогноз жизни
Давать долгосрочные прогнозы трудно, поскольку нужно учитывать, что раннее применялось устаревшее лечение. Воздействие на позднее состояние здоровья легких и последствия дополнительного инфекционного поражения охарактеризованы плохо.
Исследования детей, переживших БЛД показывают, что наблюдаются нарушения общих и защитные функций легких, астматоподобне симптомы, легочная гипертония, склонность к гипоксии.
Последствия бронхолегочной дисплазии у недоношенных детей можно резюмировать следующим:
1. Нарушение функций легких. У выживших уменьшается процент объема форсированного выдоха за 1 секунду. У некоторых пациентов с возрастом функции органа дыхания ухудшаются. Это связано с дисанаптическим ростом, при котором дыхательные пути растут менее быстро, чем паренхима легкого, что приводит к фиксированной непроходимости путей.
2. Нарушение защитных функций. Респираторные инфекции у перенесших БЛД вызывают более тяжелые заболевания. Повышенная склонность к патологиям дыхательной системы вызывает дополнительные повреждения в и без того уязвимом легком. Помимо внешнего негативного воздействия, патологический процесс осложняется хроническим рефлюксом и микроаспирацией с риском аспирационной пневмонии.
3. Астмаподобные симптомы. Исследования показали, что у 25% детей, родившихся <26 недель, в возрасте 10-11 лет диагностируется астма. При подозрении на астму и назначении бронходилататоров реакция на данные препараты снижена из-за сужения периферических дыхательных путей.
4. Нарушение газообмена. Из-за нарушения хеморецепторной функции, изменения содержания кислорода приводят к аномальным дыхательным реакциям — гипоксии, гипероксии. Также увеличивается риск нарушения функций дыхательных мышц.
5. Легочная артериальная гипертензия (ЛГ). Дисморфная легочная сосудистая сеть и нарушенный онтогенез приводят к риску повышения легочного давления. У детей с ЛГ высок риск развития поздних заболеваний сосудистой системы дыхательных органов. Применяемая стандартная вазодилататорная терапия может привести к дополнительному ингибированию пролиферации гладкомышечных клеток.
В течение первого года жизни 49% детей с БЛД требуется повторная госпитализация, и риски смертности, связанные с осложнениями, значительны.
Заключение
Определение, патофизиология, терапия бронхолегочной дисплазии значительно изменились с момента первого описания патологии. Междисциплинарная помощь, направленная на решение сложных легочных проблем, потребностей в питании и развитии имеет решающее значение и может влиять на исходы тяжелой формы БЛД.
Рендомизированные терапевтические исследования в дополнение к продольной оценке пациентов остаются необходимыми для оптимизации медицинской помощи и для дальнейшего выявления факторов риска. Тенденция демонстрирует увеличение выживаемости детей рожденных <26 недель. У половины из них диагностируется БЛД, поэтому крайне важно, чтобы в будущих исследованиях максимально были изучены механизмы и факторы, влияющие на развитие легочных постсиндромов, с целью снижения бремени болезней.
Если Вам понравилась статья пожалуйста поставьте Лайк и подпишитесь на канал, чтобы не пропустить новый материал!
Информация, размещенная на канале Дзен, носит ознакомительный характер. Обязательно проконсультируйтесь со специалистом.
Источник


