Блокаторы гистаминовых рецепторов при бронхиальной астме
Блока́торы H2-гистами́новых реце́пторов (синонимы: H2-блока́торы, H2-антигистами́нные сре́дства, антагони́сты Н2-гистами́новых реце́пторов) — лекарственные препараты, предназначенные для лечения кислотозависимых заболеваний желудочно-кишечного тракта за счёт снижения продукции соляной кислоты посредством блокирования гистаминовых H2-рецепторов париетальных клеток слизистой оболочки желудка. Относятся к антисекреторным препаратам.
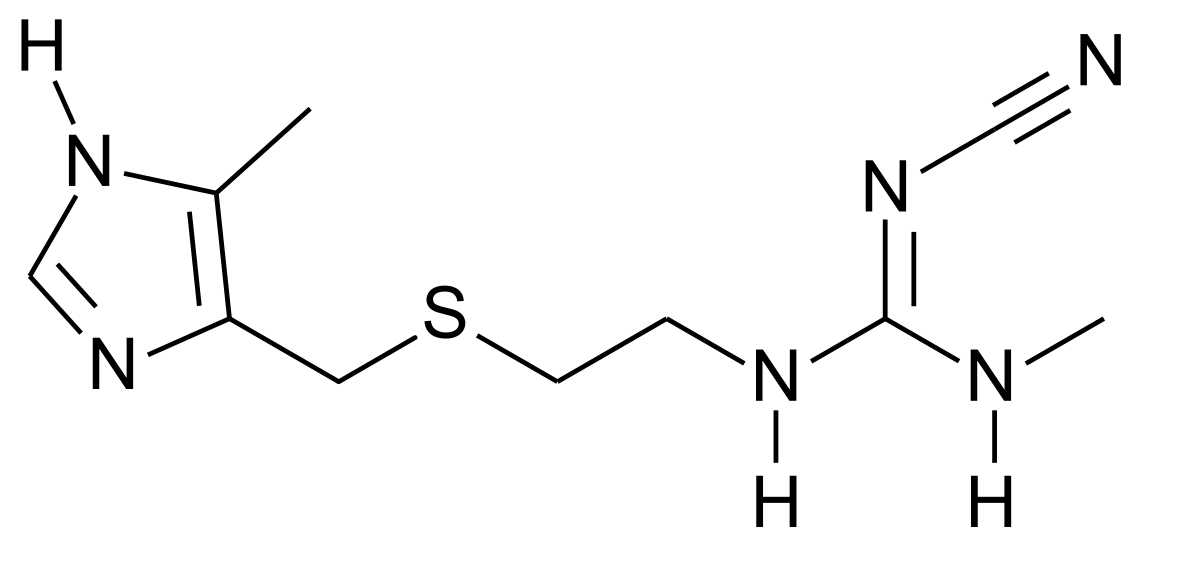
Циметидин — первый лекарственный препарат — Н2-блокатор
Из истории Н2-блокаторов[править | править код]
В начале XX века физиолог Генри Дейл и химик Джорж Баргер обнаружили неизвестное ранее биологически активное вещество, в дальнейшем идентифицированное как β-имидазолил-этиламин и позже получившее наименование гистамин. Несмотря на то, что Дейл много занимался исследованием гистамина, он не обратил внимание на его роль в секреции желудком соляной кислоты. И только после открытия этой роли учеником Ивана Павлова Львом Попельским (в 1916 году), Дейл в опытах на животных установил, что введение гистамина, увеличивая желудочную секрецию, способствует развитию язвенной болезни. В 1936 году Дейл за работы в этой области получил Нобелевскую премию.
Несмотря на значительные усилия, длительное время не было найдено вещество, тормозящее кислотостимулирующее действие гистамина, и, только в 1972 году Джэймс Блэк, работавший в фирме «Smith Kline and French» (сегодня относится к фирме «GlaxoSmithKline»), Великобритания, испробовав более 700 разных структур, обнаружил, что соединение буримамид, содержащее имидазольное кольцо в боковой цепи, действует на рецепторы желудка (позже названые Н2-рецепторами). За идентификацию Н2-рецепторов и разработку лекарственных средств, блокирующих их, Блэк в 1988 году был удостоен Нобелевской премии[1].
В 1975-м году появился циметидин («Smith Kline and French»), в 1979-м — ранитидин («Smith Kline and French»), в 1984-м — фамотидин («Merck»), в 1987-м — низатидин («Eli Lilly and Company», США). Н2-блокаторы сразу стали «золотым стандартом» терапии кислотозависимых заболеваний, а ранитидин к 1988 году — наиболее продаваемым рецептурным препаратом и оставались ими до появления ингибиторов протонного насоса (омепразола).
Клиническое использование[править | править код]
Н2-блокаторы часто используются при лечении язвенной болезни. Это связано прежде всего с их способностью уменьшать секрецию соляной кислоты. Кроме того, Н2-блокаторы подавляют продукцию пепсина, увеличивают выработку желудочной слизи, повышают синтез простагландинов в слизистой оболочке желудка, увеличивают секрецию бикарбонатов, улучшают микроциркуляцию, нормализуют моторную функцию желудка и двенадцатиперстной кишки[2].
Н2-блокаторы также применяются при лечении широко круга заболеваний желудочно-кишечного тракта, в том числе:
- гастроэзофагеальной рефлюксной болезни[3],
- острого[4] и хронического[5]панкреатита,
- диспепсии[6],
- респираторных рефлюкс-индуцированных заболеваний[7], в том числе, рефлюкс-индуцированной бронхиальной астмы[8],
- синдрома Золлингера — Эллисона[9],
- хронического гастрита и дуоденита[10],
- пищевода Барретта[11] и других кислотозависимых заболеваний.
Поколения Н2-блокаторов[править | править код]
Принята следующая классификация Н2-блокаторов по поколениям[4]:
- I поколение — циметидин,
- II поколение — ранитидин,
- III поколение — фамотидин,
- IV поколение — низатидин,
- V поколение — роксатидин.
Циметидин, Н2-блокатор I поколения, обладает серьёзными побочными проявленими: он блокирует периферические рецепторы мужских половых гормонов (андрогенные рецепторы), существенно снижая потенцию и приводит к развитию импотенции и гинекомастии. Также возможны диарея, головные боли, транзиторные артралгии и миалгии, блокирование системы цитохрома Р450, повышение уровня креатинина в крови, поражение центральной нервной системы, гематологические изменения, кардиотоксические эффекты, иммуносупрессивное действие[1][2].
Ранитидин имеет меньше типичных для циметидина побочных эффектов, а препараты последующих поколений — ещё меньше. При этом активность фамотидина в 20—60 раз превышает активность циметидина и в 3-20 раз активность ранитидина. По сравнению с ранитидином фамотидин более эффективно повышает рН и снижает объем желудочного содержимого. Длительность антисекреторного действия ранитидина — 8-10 часов, а фамотидина — 12 часов[1].
Н2-блокаторы IV и V поколений низатидин и роксатидин на практике мало чем отличаются от фамотидина и не имеют перед ним существенных преимуществ, а роксатидин даже немного проигрывает фамотидину в кислотоподавляющей активности[4].
Прочие Н2-блокаторы[править | править код]
- Ранитидина висмута цитрат — Н2-антигистаминное и антихеликобактерное средство. Предназначен для лечения язвенной болезни желудка и двенадцатиперстной кишки[12]. В США на фармакологический рынок не допущен. Ранитидин висмута цитрат признан на Маастрихтской конференции 2000 года препаратом, использующимся (наравне с ингибиторами протонного насоса) при эрадикации Helicobacter pylori в составе так называемой тройной терапии схемы первой линии[13].
- Н2-блокатор лафутидин в 2000 году выведен на рынок Японии[14] и продаётся фирмой «Taiho Pharmaceutical Company Ltd» под торговым наименованием «Protecadin»[15].
- Н2-блокатор ниперотидин при исследованиях с помощью суточной рН-метрии показал хорошие результаты по угнетению кислотопродукции[16], однако в результате дальнейших испытаний выяснилось его отрицательное влияние на печень человека[17].
- Н2-блокатор и цитопротектор эбротидин[18] считался в середине 1990-х годов одним из перспективных антисекреторных средств с антихеликобактерными свойствами[19]. По результатам долговременной внутрижелудочной рН-метрии было показано, что кислотоподавляющее действие эбротидина близко циметидину[20].
Н2-блокаторы в современной гастроэнтерологической практике. Индивидуальный подбор препаратов[править | править код]
О месте Н2-блокаторов среди других противоязвенных препаратов см. «Место ингибиторов протонного насоса среди других противоязвенных препаратов».
Из-за побочных эффектов циметидин в настоящее время не применяется. Ранитидин, чья кислотоподавляющая способность немного проигрывает фамотидину[1] (или хотя бы не превосходит[21]), но обладает более широким спектром побочных эффектов, также уходит из лечебной практики (ранитидина висмута цитрат, используемый для антихеликобактерной терапии является исключением[13]). Другие однокомпонентные Н2-блокаторы также не имеют заметных преимуществ перед фамотидином и, вынужденные, кроме того, конкурировать с ингибиторами протонного насоса, не получили широкого распространения в российском (а также мировом[1]) здравоохранении. Поэтому сегодня в России из Н2-блокаторов, с точки зрения практической гастроэнтерологии, актуален только фамотидин.
«В общем» Н2-блокаторы проигрывают по целому ряду основных характеристик ингибиторам протонного насоса, не превосходя их по другим. Однако ИПП имеют ряд недостатков, среди которых: высокий процент пациентов, имеющих резистентность к тем или иным ИПП, возможность так называемого «ночного кислотного прорыва» и т. д. В силу этого у ряда пациентов фамотидин оказывается приемлемее ингибиторов протонного насоса.
Усреднённая суточная рН-грамма желудка после приёма Н2-блокаторов: 800 мг циметидина, 300 мг ранитидина и 40 мг фамотидина (по М. В. Леоновой и Ю. Б. Белоусову[21])
Поэтому больным с язвой желудка и язвой двенадцатиперстной кишки, особенно больным с впервые выявленной язвой и с хронической язвой, резистентной к проводимой терапии, часто необходим индивидуальный подбор кислотоподавляющих препаратов[22]. Несмотря на доказанную эффективность ИПП — на купирование клинических симптомов в течение 1-3 дней от начала приема препарата существует индивидуальная чувствительность организма больного к секреторным препаратам, оценить которую можно только при проведении внутрижелудочной рН-метрии[7], на основании которой осуществляется выбор конкретного антисекреторного препарата — ингибитора протонного насоса или Н2-блокатора.
Оценка антисекреторного эффекта препаратов[править | править код]
Оценка антисекреторного действия различных препаратов проводится с помощью внутрижелудочной рН-метрии (для этого применяется ацидогастромониторы или ацидогастрометры).
Критерии оценки антисекреторного действия Н2-блокаторов не отличаются от критериев оценки антисекреторного действия ингибиторов протонного насоса.
Синдром рикошета[править | править код]
«Синдром рикошета» или «синдром отмены» — свойство Н2-блокаторов при резком прекращении их приёма вызывать увеличение кислотности и, как следствие, обострение заболевания[23].
Фармакокинетика[править | править код]
Н2-блокаторы в классификаторах, реестрах и официальных документах[править | править код]
- В Анатомо-терапевтическо-химической классификации (АТХ) существует отдельная группа «Блокаторы H2-гистаминовых рецепторов», имеющая код A02BA и входящая в раздел A02B «Противоязвенные препараты»[24]. В международном аналоге АТХ — классификаторе ATC раздел A02B называется «Препараты для лечения язвенной и гастроэзофагеальной рефлюксной болезней» (англ. Drugs for peptic ulcer and gastro-oesophageal reflux diaseas (GORD))[25].
- В Фармакологическим указателе имеется группа «H2-антигистаминные средства», которая входит в категорию «Гистаминолитики»[26].
- В «Перечень жизненно необходимых и важнейших лекарственных средств» (в раздел «А02В. „Препараты для лечения язвенной болезни желудка и двенадцатиперстной кишки и гастроэзофагальной рефлюксной болезни (ГЭРБ)“») включены ранитидин (раствор для внутривенного и внутримышечного введения; раствор для инъекций; таблетки, покрытые оболочкой; таблетки, покрытые пленочной оболочкой) и фамотидин (лиофилизат для приготовления раствора для внутривенного ведения; таблетки, покрытые оболочкой; таблетки, покрытые пленочной оболочкой).[27]
- Стандарты медицинской помощи, утверждённые Минздравсоцразвития России, определяют, что при лечении больных:
- язвой желудка и двенадцатиперстной кишки[28], гастроэзофагеальной рефлюксной болезнью[29], хроническим гастритом, дуоденитом, диспепсией[30] в 100 % случаев (исключения: хронический гастрит, дуоденит, диспепсия — в 80 % случаев) назначаются Н2-блокаторы; в том числе в 50 % из них — ранитидин в курсовой дозе от 4,2 до 8,4 г и в 50 % — фамотидин (от 0,56 до 1,12 г);
- с термическими и химическими ожогами пищевода — в 10 % случаев назначается циметидин (курсовая доза 16 г), в 10 % — ранитидин (2 г) и в 10 % — фамотидин (400 мг)[31].
- Food and Drug Administration (государственный орган США) одобрены следующие Н2-блокаторы: циметидин, ранитидин, фамотидин и низатидин. В относительно низких дозах разрешён их безрецептурный отпуск.
См. также[править | править код]
- Противоязвенные препараты и препараты для лечения гастроэзофагеального рефлюкса
Примечания[править | править код]
- ↑ 1 2 3 4 5 Бельмер С. В. Медикаментозная коррекция кислотозависимых состояний. Доктор. Ру. — 2004. — № 6. — с. 6-9.
- ↑ 1 2 Охлобыстин А. В. Применение фамотидина для лечения острых язвенных кровотечений Архивная копия от 6 мая 2005 на Wayback Machine. РМЖ, Том 10, № 8-9, 2002.
- ↑ Прохорова Л. И., Давыдова А. Н. Гастроэзофагеальная рефлюксная болезнь у детей. ВолГМУ, 2007.
- ↑ 1 2 3 Белоусова Е. А., Логинов А. Ф. Возможности блокаторов Н2-гистаминовых рецепторов в современной гастроэнтерологии. Consilium Medicum. Том 5, № 10, 2003.
- ↑ Хомерики С. Г., Хомерики Н. М. Скрытые аспекты клинического применения Н2-блокаторов. Фарматека. 2000. № 9. с. 9-15.
- ↑ Алексеенко С. А., Логинов А. Ф., Максимова И. Д. Использование малых доз Н2-блокаторов III поколения в лечении диспепсии. Consilium Medicum. Том 7, № 2, 2005.
- ↑ 1 2 Антонова Е. А., Герасимова Т. А., Луппова Н. Е., Орлов А. В., Приворотский В. Ф., Романюк Ф. П. Заболевания респираторного тракта у детей, ассоциированные с гастроэзофагеальным рефлюксом Архивная копия от 14 марта 2008 на Wayback Machine. РМЖ, 2004, т.12 № 3.
- ↑ Бейтуганова И. М., Чучалин А. Г. Рефлюкс-индуцированная бронхиальная астма. РМЖ, т. 6, № 17, 1998.
- ↑ Охлобыстин А. В. Диагностика и лечение синдрома Золлингера-Эллисона. Русский Медицинский журнал. — 1998. — Т. 6. — № 7.
- ↑ Афиногенова О. Б., Давыдов Б. И. Современные проблемы гастродуоденита у детей и подростков Архивная копия от 4 марта 2016 на Wayback Machine. Мать и дитя, № 4(19), 2004.
- ↑ Литература в статье «Пищевод Барретта».
- ↑ Реестр лекарственных средств. Ранитидина висмута цитрат.
- ↑ 1 2 Ивашкин В. Т. Лапина Т. Л. Лечение язвенной болезни: новый век — новые достижения — новые вопросы. Библиотека РМЖ. Болезни органов пищеварения. Том 4, № 1, 2002.
- ↑ Чубенко А. В. Анализ приоритетных исследований в области новых лекарственных средств за рубежом. Провизор, № 1, 2003.
- ↑ Официальный сайт фирмы Taiho Pharmaceutical Company Ltd. «Protecadin tablet», H2 receptor antagonist Архивная копия от 20 сентября 2008 на Wayback Machine.
- ↑ Palasciano G, Maggi V, Portincasa P. The effect of the H2-antagonist niperotidine on intragastric acidity in healthy subjects undergoing 24-hour pH-monitoring. Italian Journal of Gastroenterology. 1990 Oct;22(5):291-4. PMID 1983712
- ↑ Gasbarrini G, Gentiloni N, Febbraro S, Gasbarrini A, Di Campli C, Cesana M, Miglio F, Miglioli M, Ghinelli F, D’Ambrosi A, Amoroso P, Pacini F, Salvadori G. Acute liver injury related to the use of niperotidine. Journal of Hepatology. 1997 Sep;27(3):583-6. PMID 9314138
- ↑ Ebrotidine
- ↑ Бардахчьян Э. А., Камнева Н. В., Харланова Н. Г., Ломов С. Ю. Современные аспекты лечения хеликобактериоза Архивная копия от 14 февраля 2009 на Wayback Machine.
- ↑ Munoz-Navas M., Honorato J., Reina-Arino M., Marquez M., Herrero E., Villamayor F., Torres J., Roset P. N., Fillat O., Camps F., Ortiz J. A. Arzneimittel-Forschung 47(4A):539-44, 1997 AprContinuous Intragastric pH Monitoring in the Evaluation of Ebrotidine, Cimetidine and Placebo on Gastric Acidity in Healthy Volunteers
- ↑ 1 2 Леонова М. В., Белоусов Ю. Б. Н2-блокаторы в гастроэнтерологической практике. М., 1996.
- ↑ Махакова Г. Ч., Дичева Д. Т., Одинцова Т. А., Сигаловская Л. Л., Гембицкая Т. А. Сравнительная характеристика кислотоподавляющих препаратов путём проведения фармакологических проб при интергастральной суточной рН-метрии. Лечащий врач, 1999, № 6, с. 24-26.
- ↑ Успенский Ю. П., Пахомова И. Г., Ткаченко Е. И. Первый в России опыт использования альгинатсодержащего препарата в лечении ГЭРБ. Лечащий врач, 2007, № 8.
- ↑ Реестр лекарственных средств. Анатомо-Терапевтически-Химическая (АТХ) классификация. Противоязвенные препараты.
- ↑ The WHO Collaborating Centre for Drug Statistics Methodology. A02B Drugs for peptic ulcer and gastro-oesophageal reflux diaseas (GORD). Войти в «Complete ATC index 2008», ввести код A02BC, установить флаг «АТС» и нажать «search»..
- ↑ Реестр лекарственных средств. Фармакологический указатель. Гистаминолитики.
- ↑ Распоряжение Правительства Российской Федерации от 30.12.2009 № 2135-р.. Российская газета. Федеральный выпуск № 5082 от 13 января 2010 г.
- ↑ Стандарт медицинской помощи больным язвой желудка и двенадцатиперстной кишки. Приказ Минздравсоцразвития от 22.11.2004 № 241
- ↑ Стандарт медицинской помощи больным гастроэзофагальным рефлюксом. Приказ Минздравсоцразвития от 22.11.2004 № 247
- ↑ Стандарт медицинской помощи больным хроническим гастритом, дуоденитом, диспепсией. Приказ Минздравсоцразвития от 22.11.2004 № 248
- ↑ Стандарт медицинской помощи больным с термическими и химическими ожогами пищевода. Приказ Минздравсоцразвития от 06.07.2006 г., № 525
Источники[править | править код]
- Статьи Википедии: en:H2 antagonist, en:Ranitidine, en:Famotidine, en:Nizatidine, en:Niperotidine
Источник
Гистамин идентифицирован в 1910 году H.Dale и P.Laidlaw и с тех пор считается главным медиатором аллергических нарушений (ринит, бронхиальная астма, крапивница, анафилаксия). Истинный механизм действия гистамина долгое время оставался неизвестным. A.S.F.Ash и H.O.Schild в 1966 г. выдвинули гипотезу, что гистамин действует, по крайней мере, через два подтипа рецепторов: Н1-гистаминовый рецептор и Н12-рецептор, ответственный за желудочную секрецию. В последние годы стало очевидным, что гистамин также является нейротрансмиттером и широко распространен в тканях. Наиболее высокая концентрация отмечается в коже, легких, слизистой желудочно-кишечного тракта. В 1983 г. J.M.Arrang и соавт. идентифицировали новый гистаминэргический рецептор подтипа НЗ. Показано, что НЗ-рецептор, представленный, главным образом, в центральной нервной системе и участвующий в таких функциях как сон/бодрствование, гормональная секреция, кардиоваскулярный контроль и др., может рассматриваться как генеральная регуляторная система и потенциальная мишень для новых терапевтических вмешательств.
Эффекты, опосредуемые Н1-гистаминовыми рецепторами. Гистамин оказывает сильное воздействие на сердечно-сосудистую систему, вызывая расширение артериол, увеличивая проницаемость сосудов, воздействуя на эндотелий посткапилярных венул, расширяя сосуды головного мозга. Локальное внутрикожное освобождение гистамина приводит к местному покраснению кожи в результате расширения сосудов, появлению волдыря в результате повышения проницаемости капилляров и гиперемии в окружающем участке, за счет рефлекторного механизма расширения артериол. Воздействуя на гладкую мускулатуру гистамин, может вызвать сильное сужение бронхов у чувствительных лиц, стимулирует перистальтику желудочно-кишечного тракта. Гистамин усиливает секрецию экзокринных желез — слюнных и бронхиальных, воздействует на эндокринные железы, стимулируя освобождение катехоламинов из хромаффинных клеток надпочечников. Воздействуя на сенсорные нервные окончания гистамин, может вызвать сильный зуд.
S.Weiss и соавт. (1929) одними из первых показали, что внутривенное введение гистамина вызывает приступы затрудненного дыхания у больных с бронхиальной и сердечной астмой, вследствие бронхиальной обструкции и снижения жизненной емкости легких. В то же время у здоровых волонтеров даже токсические дозы гистамина не вызывают бронхиальную обструкцию. Действие же гистамина у больных бронхиальной астмой является следствием повышенной чувствительности к нему [Curry J., 1946]. Способность ингаляций гистамина вызывать бронхоконстрикцию у больных бронхиальной астмой в настоящее время широко используется для измерения реактивности дыхательных путей. В провокационном тесте с гистамином определяется концентрация гистамина, вызывающая падение ОФВ1 на 20% (PC 20).
В серии экспериментов было показано, что гистамин локализуется в тучных клетках и базофилах. Две группы исследователей, независимо друг от друга, открыли реагиновые антитела (IgE) и наличие высокоаффинных рецепторов к ним на тучных клетках [Ishizaka К., IshizakaT., 1967; Johansson S., Bennich H., 1967]. Гистамин — один из главных медиаторов реакций гиперчувствительности I типа, накапливается в гранулах тучных клеток и в базофилах. Освобождение его из гранул может запускаться физическим повреждением тканей, различными химическими агентами, но в наибольшей степени — взаимодействием комплексов антиген-антитело. При аллергических реакциях из предварительно сенсибилизированных тучных клеток гистамин выделяется вместе с вновь образующимися медиаторами такими как лейкотриены и простагландины. Небольшие количества гистамина также могут продуцироваться микроорганизмами, находящимися в дыхательных путях (Branchamella catarhalis, Haemopphilus parainfluenzae, Pseudomonas aeruginosa). При бронхиальной астме эффекты гистамина более разнообразны, чем просто бронхоконстрикция, впервые описанная S.Weiss. Последняя является следствием не только прямого действия гистамина на гладкую мускулатуру, но также стимуляции афферентных сенсорных нервов дыхательных путей. Оба эти эффекта реализуются через Н1-гистаминовые рецепторы. Гистамин также увеличивает секрецию вязкой слизи.
Выделившийся гистамин быстро диффундирует в окружающие ткани и появляется в крови через 2,5 мин, достигает пика через 5 мин, и возвращается к базальному уровню через 15-30 мин. Только 2-3% гистамина экскретируется в неизмененном виде, остальное метаболизируется. При аллергии увеличивается количество свободного гистамина и других медиаторов, которые являются причиной ранних клинических симптомов аллергических реакций в коже (атопический дерматит, крапивница), дыхательных путях (аллергический ринит, бронхиальная астма), пищеварительном тракте (пищевая аллергия).
При развитии аллергических симптомов, нередко очень выраженных и нарушающих состояние ребенка, для оказания быстрой и эффективной помощи используют антигистаминные препараты, блокирующие антигистаминовые рецепторы на клетках и препятствующие дальнейшим аллергическим проявлениям. Антагонисты гистаминовых рецепторов Н1 (Н1-блокаторы) обладают замещенной боковой этиламиновой цепью (как и сам гистамин), связанной с одной или большим числом циклических групп. Сходство между этиламиновой частью гистамина и замещенной этиламиновой структурой Н1 -блокатора позволяет предполагать, что такая конфигурация молекулы имеет значение для взаимодействия с рецептором [Yamashita М. et al., 1991; Borea Р.А. et al., 1986]. Блокаторы Н1-рецепторов действуют путем конкурентного ингибирования, они не влияют существенно на образование и разрушение гистамина [Bousquet J., Campbell A.M. et al., 1996]. Н1-блокаторы при пероральном применении хорошо всасываются в желудочно-кишечном тракте. Действие их обычно начинается через 15-30 мин, максимальный эффект развивается через 1 ч и длительность действия составляет 3-6 ч, но некоторые современные блокаторы действуют значительно дольше.
Антигистаминный эффект блокаторов Н1-рецепторов отмечается только при повышенной концентрации гистамина. Они блокируют воздействие гистамина на гладкую мускулатуру желудочно-кишечного тракта, эффективно блокируют повышение проницаемости капилляров и раздражение чувствительных нервных окончаний, гиперемию, зуд и чихание, повышенное выделение слизи. Аллергическая реакция мускулатуры бронхов зависит не только от высвобождения гистамина, и одни только антигистаминные препараты на нее существенно не влияют.
Антигистамины, или антагонисты Н1-гистаминовых рецепторов, были открыты Bovet и Staub в 1937 г. С 1940 по 1950 годы антигистаминные препараты рассматривались как “чудодейственные средства” и использовались в лечении заболеваний, сочетающихся с любым аллергическим процессом, включая бронхиальную астму. В 1949 г. H.Herxheimer использовал антигистаминные препараты в лечении бронхиальной астмы, однако ранние антигистамины были неспецифичны и имели побочные эффекты, включая непереносимость и даже бронхоконстрикцию. Антигистаминные препараты оказались полезными и при лечении других аллергических заболеваниях, в том числе сезонной сенной лихорадки, аллергического ринита и конъюнктивита. Хорошо поддаются лечению ими острая и хроническая крапивница, атопический дерматит.
У детей может требоваться более частое, чем взрослым введение антигистаминных препаратов, так как в организме ребенка они имеют более короткий период полураспада. Выделяют несколько классов антигистаминов более или менее эквивалентных по эффективности, но отличающихся по их побочным эффектам. Это позволило отнести первое поколение антигистаминных препаратов к седативным антигистаминам, так как среди побочных эффектов доминировал седативный эффект, что учитывается в дальнейшей дифференциации клинических показаний.
Истинная частота побочных эффектов антигистаминов первого поколения неизвестна. Антигистамины преодолевают гематоэнцефалический барьер и могут приводить к слабости, утомляемости, сонливости, ухудшению когнитивных функций и школьной успеваемости. У детей в возрасте 1-3 лет антигистамины могут оказывать парадоксальный эффект и вызывать раздражительность, нервозность, гиперактивность и судороги. Кроме того, они могут вызывать антихолинергические эффекты — нарушение зрения, сухость слизистых оболочек и др.
В 1950 г. появляются данные, свидетельствующие о том, что антигистаминные препараты не только не полезны при лечении бронхиальной астмы, но могут быть даже опасными, так как повышают вязкость бронхиального секрета и таким образом могут ухудшать течение астмы. В последующие годы антигистаминные препараты не использовались при бронхиальной астме. В течение последних 20 лет с появлением второго поколения лекарств этого класса ситуация изменилась. Антигистамины этого поколения обладают большей специфичностью, длительностью действия и меньшими побочными эффектами. Появились работы, свидетельствующие, что антигистамины не являются опасными в лечении астмы, если пациенты имеют симптомы, которые требуют использования этих препаратов (табл. 16-1).
Антигистаминные препараты второго и третьего поколений могут ингибировать выделение тучными клетками и базофилами провоспалительных медиаторов, оказывая антиаллергическое и антивоспалительное действие, уменьшая явления бронхоспазма. Антигистамины второго поколения получили также название “не метаболитов”, так как препараты метаболизируются после попадания в организм и свое действие оказывают как в качестве исходного вещества (“родительский” препарат”), так и появляющихся активных метаболитов.
Третье поколение антигистаминов — “метаболиты”, включают на сегодня два препарата фексофенадин (Телфаст) и цетиризин (Зиртек). Фексофенадин представляет активный метаболит неседативного Н1-антигистаминного препарататерфенадина, цетиризин — метаболит гидроксизина. Таким образом, в организм попадают уже непосредственно активно действующие вещества.
Фармакологические свойства антагонистов Н1-рецепторов 2-3 поколения (табл. 16-2). Они являются потенциальными и неконкурентными блокаторами Н1-рецепторов, обладают антиаллергической активностью. Их абсорбция не снижается при приеме с пищей, лекарственные взаимодействия не известны.
Таблица 16-1
| 1-поколение: | клемастин (Супрастин) | дифен гидрамин (Димедрол) | мебгидролин (Диазолин) | гидроксизин (Атаракс) |
| 2-поколение: | терфенадин | лоратадин | астемизол | эбастин |
| не метаболиты | (Телдан) | (Кларитин) | (Гисманал) | (Кестин) |
| 3-поколение: метаболиты | фексофенадин (Телфаст) | цетиризин (Зиртек) |
Таблица 16-2
| Препарат | Путь введния | Доза | Лекарственная форма |
| Зиртек (цетиризин) | Внутрь | 2-6 лет 5 мг (10 кап.) 1 раз/сут или по 2,5 мг (5 кап.) 2 раза/сут старше 6 лет 10 мг в сут | Капли 1мл (10мг) Таблетки 10 мг |
| Кларитин (лоратадин) | Внутрь | 2—12 лет 5 мг (1 /2 т или 1 ч. л. сиропа) 1 раз/сут старше 12 лет 10 мг 1 раз сут | Таблетки 10 мг Сироп 5 мл 5 мг |
| Телфаст (фексофенадин) | Внутрь | Детям старше 6 лет 30 мг, 120 мг или 180 мг 1 раз/сут | Таблетки 30, 120 и 180 мг |
| Костин (эбастин) | Внутрь | Детям старше 12 лет 10 мг 1 раз/сут | Таблетки 10 мг |
| Гисманал (астемизол) | Внутрь | 6-12 лет 5 мг/1 раз/сут до 6 лет суспензия 0,2 мг/кг/сут | Таблетки 10 мг Суспензия 1мл 1мг |
У этих препаратов отсутствуют седативный и антихолинергический побочные эффекты, влияние на прибавку в массе. Отмечаются быстрое начало действия, длительность эффекта не менее 24 ч, отсутствие тахифилаксии.
Антагонисты Н1-гистаминовых рецепторов применяют для лечения аллергических нарушений у детей уже в течение десятилетий. Их используют для облегчения таких симптомов как чихание, ринит, конъюнктивит, зуд, крапивница, атопический дерматит. Потенциально седативные антигистаминные препараты первого поколения продолжают широко использовать у детей старше 1 года жизни, так как пока отсутствуют регламентирующие документы по применению препаратов второго поколения у детей до 12 лет.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Страницы: 1 2
Источник