Бронхиальная астма гормонозависимая смешанной формы

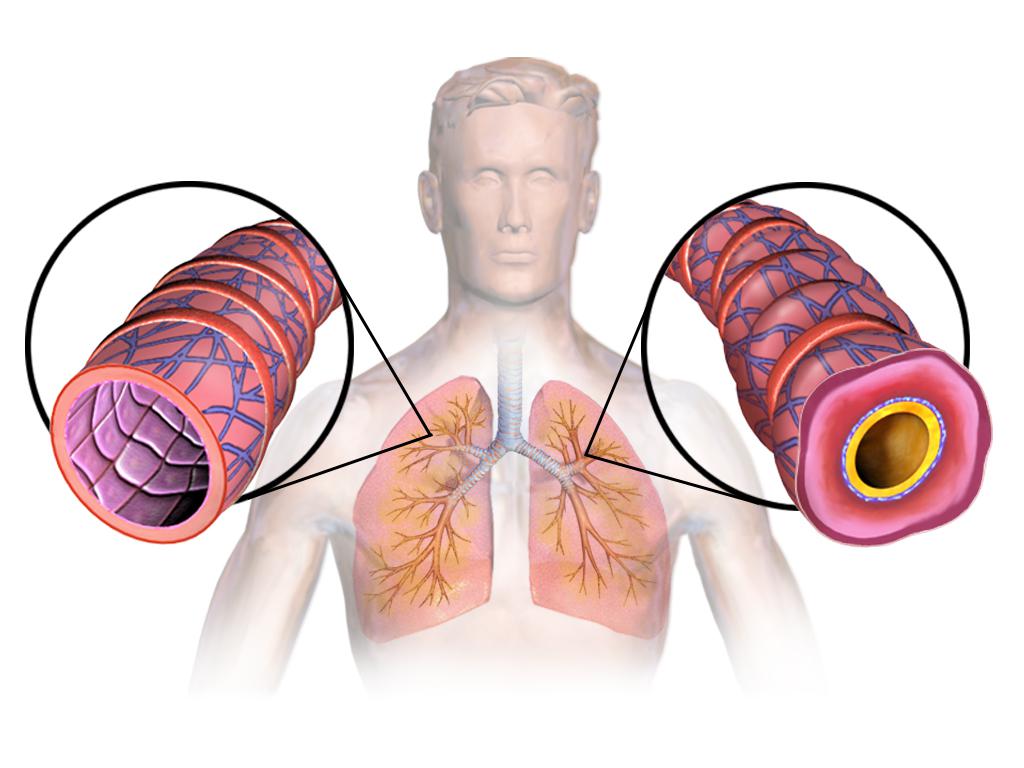
Бронхиальная астма — распространенное заболевание нижних дыхательных путей с разнообразными формами проявлений. Смешанная астма — одна из них, формируется в результате совместного влияния внутренних и внешних факторов на организм человека. Заболеванию подвержены дети старше 5 лет, реже оно встречается у взрослых.
Что же такое смешанный тип астмы, отчего возникает, как его распознать и что делать при появлении болезни, рассмотрим далее.
Особенности смешанной бронхиальной астмы

Смешанная форма бронхиальной астмы — проявление хронического воспалительного процесса в дыхательной системе, протекает в среднетяжелой и тяжелой форме. Она возникает из-за повышенной чувствительности бронхов, что приводит к сужению бронхиального просвета под влиянием различных раздражителей. Это состояние вызывается сокращением гладкой мускулатуры бронхов, отек слизистой оболочки и скопление избыточного количества слизи на ее стенках.
Данная патология формируется под влиянием факторов экзогенного (аллергического) и эндогенного (неаллергического) типа. Если заболевание комбинирует обе формы, значит, оно имеет смешанную природу происхождения.
При смешанной астме существует непосредственная взаимосвязь не только с внешними раздражителями (попадающими в организм через дыхательные пути), но и скрытыми инфекционными заболеваниями (органов дыхания, зубов, желудка, кишечника и других внутренних органов).
Болезнь отличается рецидивирующим течением с многократными обострениями и трудноустранимыми приступами.
Классификация бронхиальной астмы

Смешанная бронхиальная астма классифицируется по следующим признакам: по выраженности течения, форме заболевания, контролируемости процесса.
- Тяжесть протекания болезни.
Особенности течения:
- Легкая степень – характерны незначительные обострения, которое легко устраняются с помощью бронхолитических препаратов.
- Средняя степень тяжести смешанной формы бронхиальной астмы приводит к уменьшению физической активности человека, нарушениям режима сна. При ней отмечается возникновение более тяжелых и продолжительных обострений (несколько в неделю), иногда сопровождающихся приступами удушья. Для снижения негативных последствий астматику необходим ежедневный прием бронхорасширяющих препаратов.
- Тяжелая степень является самой опасной. Она сопровождается частичным или полным ограничением физической активности, затруднением речи, паническим состоянием, общей слабостью, частыми приступами. Приступы в этот период могут перейти в астматический статус, что представляет серьезную угрозу для жизни больного.
В зависимости от тяжести течения болезнь может носить эпизодический характер (развиваться постепенно с редкими приступами) или быть постоянной и протекать в легкой, средней или тяжелой форме.
- Контроль заболевания.
По контролируемости процесса астма бывает:
- контролируемой — с отсутствием негативных проявлений и ограничений для любого вида деятельности;
- частично контролируемой — появляются клинические признаки с умеренным количеством обострений;
- неконтролируемой — наблюдаются множественные симптомы, значительное количество обострений, возникновение астматических приступов.
Для установления контроля над заболеванием больному необходимо научиться самостоятельно пользоваться пикфлоуметром (для определения максимальной скорости выдоха). Это поможет определить начало обострения, своевременно принять назначенные препараты и снизить риск появления астматических приступов.
Причины заболевания

В основе генеза бронхиальной астмы смешанного типа лежат различные механизмы, провоцирующие заболевание.
Данная патология является результатом одновременного влияния аллергических и неаллергических причин.
Воздействие экзогенных факторов ведет к появлению аллергической реакции на определенные вещества, воспринимаемые организмом как чужеродные.
Провокаторами астмы являются аллергены, попадающие в дыхательные пути из внешней среды:
- шерсть и пух домашних питомцев;
- сухие корма;
- бытовые средства для уборки, стирки и мытья посуды;
- пылевые клещи;
- пыльца цветущих растений;
- споры грибов;
- укусы насекомых;
- резкие запахи;
- курение и вдыхание табачного дыма;
- аллергенные продукты питания.
Эндогенные (внутренние) причины являются результатами нестабильного физиологического состояния человека:
- осложнение вирусных инфекций;
- эндокринные нарушения;
- хронические заболевания внутренних органов;
- физические и эмоциональные перегрузки;
- переохлаждение организма;
- климатические условия;
- побочные эффекты от приема лекарственных препаратов.
Так как бронхиальная астма смешанной формы развивается под влиянием аллергенов и инфекции, она относится к осложненной форме болезни и нуждается в особом подходе.
Симптомы астмы смешанного типа

Для астмы смешанной формы характерны периоды обострения, затихания воспалительных процессов и ремиссии.
Заболевание сопровождается определенными клиническими признаками:
- затрудненное дыхание;
- возникновение удушья;
- появление зудящей сыпи;
- нарушение выведения мокроты;
- ощущение сдавливания грудной клетки;
- свистящие хрипы на выдохе;
- возникновение кашля (особенно в ночное время);
- ухудшение общего самочувствия;
- появление субфебрильной температуры;
- аллергические проявления.
Основным проявлением бронхиальной астмы смешанного генеза являются продолжительные приступы удушья. Во время астматического приступа отмечается сужение бронхов, возникает кашель и нарушение дыхательной функции.
Это состояние может продолжаться в течение нескольких минут или часов и купироваться с помощью ингалятора. Если лекарство не оказывает действия и приступ не прекращается, необходимо госпитализировать больного.
Диагностика

Диагностические мероприятия являются основным методом выявления бронхиальной астмы смешанного типа.
В них входят:
- обследование и опрос пациента;
- исследование в лабораторных условиях анализов крови и отделяемой слизи;
- использование спирометрии для анализа функциональных показателей работоспособности легких и бронхов;
- проведение провокационных проб с целью выявления аллергена;
- рентгенографические исследования с целью исключения возможных осложнений;
- бронхоскопическое исследование легких.
С помощью тщательно проведенной диагностики врач определяет тяжесть течения болезни и подбирает соответствующее лечение.
Лечение смешанной бронхиальной астмы

Первоочередными задачами в борьбе с бронхиальной астмой смешанного генеза являются:
- уменьшение выраженности клинических признаков;
- устранение влияния триггеров;
- предотвращение обострений;
- оценивание показателей функции дыхания;
- повышение активности больного и улучшение его состояния;
- исключение побочных эффектов от приема лекарств;
- обучение астматика измерению скорости выдоха:
- контролирование течения болезни.
Особенностью протекания смешанной астмы является сочетание аллергических и неаллергических проявлений, что подразумевает использование комплексного лечения. Оно включает прием препаратов системного и симптоматического действия.
Системное лечение проводится в течение продолжительного времени (иногда на протяжении всей жизни). Оно дает долгосрочное облегчение, предупреждая появление обострений болезни, и помогает контролировать ее состояние.
Базисная терапия
В базисную терапию входит прием следующих медикаментов:
- кортикостероидных средств в таблетках или инъекциях — применяют для разжижения мокроты и ее отхождения при средней тяжести болезни, а также при длительном бронхоспазме и астматическом статусе;
- бета-2-агонистов длительного воздействия — способствуют расширению просвета бронхов. При среднетяжелом или тяжелом течении болезни используется комбинация ингаляционного гормона с бета-агонистом;
- антихолинергических средств — способствуют расширению бронхов, уменьшают выработку слизи, устраняют кашель и одышку;
- глюкокортикостероидных препаратов (ингаляционных гормонов) — снимают воспаление, что позволяет снизить гиперактивность бронхов и устранить спазм бронхов, снизить отек слизистой оболочки. Их назначают, когда заболевание имеет тяжелое течение и трудно поддается лечению. Используют короткими курсами, так как они обладают серьезными побочными эффектами.
У каждого человека индивидуальные предвестники приступа астмы, поэтому важно научиться определять наступление этого момента.
Его основные симптомы:
- озноб;
- головная боль;
- беспокойство;
- боль в горле;
- чихание;
- приступообразный кашель;
- слабость.
Использование симптоматических средств быстрого реагирования — аэрозолей и ингаляторов — в нужный момент поможет улучшить состояние больного и предотвратить развитие приступа.
Вспомогательное лечение
В качестве вспомогательного лечения используется физиотерапия:
- лечебный массаж;
- электрофорез;
- ультразвук;
- магнитотерапия;
- амплипульс;
- криотерапия.
Проведение процедур позволяет улучшить функциональность дыхательных путей, снизить воспаление, нормализовать кровообращение, а также снизить восприимчивость организма к воздействию аллергенов.
Следует помнить, что все лекарственные препараты необходимо применять строго по назначению врача.
Не рекомендуется самостоятельно прерывать лечение при улучшении общего самочувствия и исчезновении симптомов заболевания. Это может привести к прогрессированию болезни и возвращению всех проявлений в более тяжелой форме.
Прогноз
Спрогнозировать результат лечения не представляется возможным, так как астма смешанного типа способна спровоцировать серьезные нарушения в работе дыхательной системы и вызвать осложнения.
Однако своевременно начатое лечение и выполнение всех предписаний врача способно приостановить развитие болезни и привести к продолжительной ремиссии.
Профилактика смешанной астмы
Профилактические мероприятия являются неотъемлемой частью борьбы со смешанной формой бронхиальной астмы. Они помогают предупредить прогрессирование астмы или облегчить ее проявления.
Общие рекомендации:
- применение защитных средств при использовании средств бытовой и строительной химии;
- частое пребывание на свежем воздухе;
- закаливание и повышение защитных свойств организма;
- отказ от тяжелых физических нагрузок;
- исключение из рациона продуктов питания, являющихся аллергенами;
- проведение ежедневной влажной уборки жилого помещения;
- ограничение или полный отказ от контакта с домашними животными;
- освоение дыхательной гимнастики;
- отказ от курения и чрезмерного употребления алкоголя;
- применение способов самоконтроля состояния болезни.
Бронхиальную астму невозможно вылечить полностью. Но правильное лечение и регулярное выполнение некоторых правил поможет установить контроль над заболеванием. Это позволит человеку вернуться к полноценной жизни.
Источник
Изобретение относится к медицине, а именно к терапии, и касается лечения гормонозависимой бронхиальной астмы. Предложено в выделенную аутогенную клеточную массу крови, включающую все клетки корви, полученную из 6-8% ОЦК, вводить 30/120 мг преднизолона и 1-2 мл раствора АТФ 100 мкг/мл. Полученная клеточная масса перед возвратом больному инкубируется в течение 20 мин при комнатной температуре. Способ позволяет уменьшить время и количество операций при проведении процедуры по сравнению со способом, принятым за прототип, ускорить наступление более быстрого клинического улучшения, уменьшить курсовую дозу и суточную дозу преднизолона, значительно снизить поддерживающую дозу преднизолона в постгоспитальном периоде. 1 з.п. ф-лы, 2 табл.
Предложенный способ лечения относится к медицине, к методам эфферентной хирургии и может быть использован для лечения больных гормононезависимой бронхиальной астмой (БА).
Неуклонный рост заболеваемости БА, занимающей значительную роль среди заболеваний дыхательных путей, прогрессирующее течение болезни, приводящее к длительной нетрудоспособности, а зачастую к инвалидизации, диктует необходимость изыскания новых методов более эффективного патогенетического лечения данного заболевания.
Известен способ лечения тяжелых форм бронхиальной астмы глюкокортикостероидными препаратами (ГКС) (см., например, (Г.Б. Федосеев, Г.П. Хлопотова, 1988 г.). Эти препараты обладают мощным противовоспалительным и антиаллергическим действием. Обычно в период обострения назначаются высокие дозы стероидов внутривенно (120-150 мг преднизолона в сутки), которые впоследствие снижаются. При необходимости больные переводятся на поддерживающие ремиссию и периодически увеличивающиеся дозы пероральных форм ГКС.
Недостатком данного способа является то, что отмена ГКС влечет за собой обострение заболевания, а длительный прием постоянно увеличивающихся доз, неизбежно приводит к развитию ряда тяжелых осложнений (стероидный сахарный диабет, кушингоид, остеопороз, пептические язвы ЖКТ, иммунодепрессия).
Наиболее близким по техническому решению является способ лечения глюкокортикоидзависимых атопических заболеваний (см. например, И.С. Гущин, Ю.А. Порошина. Патент РФ N 2003350 от 01.03.91) и заключающийся в том, что в процессе цитафереза выделяют лейкоцитарную взвесь в количестве 4-8 млд клеток, обрабатывают их преднизолоном в концентрации 20-40 мкг/мл и В12 в концентрации 1-3 мкг/мл и инкубируют при 37 градусах в течение 3 часов, трижды отмывают физиологическим раствором и после центрифугирования возвращают больному. Этот способ мы принимаем за прототип.
Недостатками способа являются длительность, трудоемкость процедуры, необходимость использования дорогостоящего оборудования и расходных материалов.
Целью предлагаемого технического решения является упрощение способа, уменьшение времени на его осуществление и снижение затрат на проведение процедуры.
Поставленная цель достигается методом, отличием которого от прототипа является то, что для инкубации используется вся клеточная масса, полученная в результате плазмафереза из 8% объема циркулирующей крови больного, к которой добавлялся АТФ в дозе 1-2 мл и ГКС (например, преднизолон в дозе 30-120 мг в зависимости от принимаемой пероральной поддерживающей дозы гормона).
Схема способа.
1. Забор крови у больного в объеме около 400 мл (примерно 8% от ОЦК) с добавлением 5 000 ед. гепарина.
2. Центрифугирование при 2 000 об/мин в течение 15 мин с последующим удалением плазмы (центрифужный плазмаферез).
3. Внесение в клеточную массу АТФ в дозе 100 мкг/мл (1-2 мл) и преднизолона в расчете 3:1 от принимаемой пероральной поддерживающей дозы. Такое соотношение выбрано нами, исходя из фармакодинамики препарата. Так, известно, что около 70% глюкокортикоидов при парентеральном введении инактивируется транскортином (Ю.Б. Бeлoуcoв, В.С. Моисеев 1993 г.) Следовательно количество активного препарата после реинфузии соответствует ранее принимаемой энтеральной дозе.
4. Инкубация полученной смеси при комнатной температуре в течение 20 минут.
5. Возвращение инкубационной смеси в кровоток больного внутривенно капельно.
Курс лечения обычно составляет 3-5 сеансов. Интервал между процедурами составляет двое суток. Критерием количества сеансов и интервала между ними является время наступления клинического эффекта и используемая ранее доза гормона.
В зависимости от быстроты наступления и выраженности клинического эффекта, доза гормона снижается на 20-30 мг за процедуру после наступления клинического улучшения.
Для обоснования указанных режимов приводятся следующие положения.
1. Объем 8% ОЦК не вызывает у больного нарушений реологии, значительных изменений со стороны биохимических показателей и системной гемодинамики.
2. АТФ в дозе 100 мкг/мл, добавленная к клеточной массе, как показано нами, активирует фагоцитарную активность лейкоцитов, повышая, в среднем, количество фагоцитирующих лейкоцитов вдвое.
3. Содержащие преднизолон лейкоциты, хемотаксис которых активирован АТФ, мигрируют из кровотока к очагу воспаления, осуществляя тем самым направленный транспорт лекарственного препарата и поддержание терапевтических концентраций в очаге воспаления при значительном снижении суточной и курсовой дозы.
4. Интервал между процедурами выбран эмпирически, основываясь на том, что исходя из нашего опыта, клинический эффект от введения преднизолона данным способом продолжается около 48 часов.
Подтверждение различий во времени проведения процедуры и в количестве манипуляций в сравнении с прототипом показано в таблицах 1 и 2.
Кроме того, упрощение предлагаемого способа заключается в: 1. Уменьшении объема забираемой крови для выделения клеточной массы, предназначенной для обработки (в предлагаемой методике — 400 мл, а в методике, принятой за прототип, — не менее 1200 мл крови).
2. В предлагаемой методике не используется дорогостоящее оборудование (аппараты для цитофереза) и трудоемкие методики для выделения лейкоцитарной массы.
3. Возможность проведения процедуры в не профилированных больницах врачами, не имеющими специальной квалификации.
Проверка заявленного технического решения на соответствие его критерию «существенные отличия» показала, что ни в научной, ни в патентной литературе не выявлено совокупности признаков, указанных в формуле изобретения.
Предлагаемое техническое решение, по нашему мнению, соответствует критерию «новизна», поскольку в доступной нам литературе мы не встретили сообщений об использовании преднизолона и АТФ для инкубации в суммарной клеточной массе крови с последующей реинфузией у больных с бронхиальной астмой.
Приводим конкретные примеры осуществления различных способов глюкокортикостеродной терапии гормонозависимых форм бронхиальной астмы.
Пример 1. Больной Щ., 62 г.
Диагноз: бронхиальная астма инфекционно-зависимая тяжелое течение, приступный период. Эмфизема легких. Кушингоид. Хроническое легочное сердце, декомпенсация. НК 2 Б ст.
Болен 5 лет, частые приступы удушья до 5-6 paз в сутки, снимающиеся ингаляцией беротека или астмопента. В течение 3-х лет принимает преднизолон 30-35 мг в сутки. В течение последних 2-х недель участились приступы удушья до 8 в сутки, снимаются только в/в введением эуфиллина. Доставлен в стационар бригадой СМП. Объективно: состояние средней тяжести, обусловленное симптомами дыхательной недостаточности. В анализах крови: увеличение СОЭ, лейкоцитоз с нейтрофилезом, увеличение агрегационно-адгезивных свойств тромбоцитов, снижение содержания иммуноглобулинов классов М и G. Проводимая терапия была малоэффективна (ингаляция беротека, в/в эуфиллин, бромгексин, глюкокортикоиды — перорально 25 мг и парентерально 30 мг). В связи с этим был взят на проведение курса экстракорпорального лечения. Больному было проведено 5 сеансов фракционного плазмафереза с инкубацией возвращаемой клеточной массы с преднизолоном в присутствии АТФ. Доза преднизолона составила 90 мг на 1 и 2 сеанса, 60 мг на 3 и 4, и 30 мг на 5 сеансе. Стойкое клиническое улучшение отмечалось уже после 2 сеанса и в последующих процедурах проводилось постепенное снижение дозы гормона. Интервал между процедурами составлял 2 суток. При повторном обследовании отмечалась нормализация показателей крови, при повторном исследовании функции внешнего дыхания — улучшение бронхиальной проводимости. Время пребывания в стационаре составило 22 койко-дня. Больной выписан со стойким клиническим улучшением на поддерживающей дозе преднизолона 15 мг в сутки. В течение 3-х месяцев, по настоящее время, у больного отмечается стойкая ремиссия заболевания.
Пример 2. Больной К. 36 л. Диагноз: бронхиальная астма, смешанный вариант, гормонозависимая, тяжелое течение, приступный период. Эмфизема легких. ДН 1.
Болен с детства, принимает преднизолон в течение 19 лет по 10 мг ежедневно. Ухудшение состояния в течение последних 3-х недель, лечение амбулаторно (антибиотики, бронхолитики, доза преднизолона увеличена до 30 мг), улучшения состояния не было, направлен на стационарное лечение. При поступлении: жалобы на приступы удушья, одышку, сухой кашель с трудноотделяемой мокротой. Приступы до 4-6 раз в сутки, снимаются ингаляцией беротека. Состояние средней степени тяжести, обусловлено дыхательной недостаточностью. В легких по всем полям сухие свистящие хрипы. ЧДД 22 в мин. В анализах крови лейкоцитоз с лимфоцитозом, увеличение СОЭ, повышение агрегационно-адгизивных свойств тромбоцитов, увеличение содержания фибриногена. При исследовании ФВД: снижение ЖЕЛ при значительном ухудшении бронхиальной проводимости. Взят на курс фракционного плазмафереза с инкубацией возвращаемой клеточной массы с преднизолоном. Проведено 5 сеансов, доза преднизолона составила 90 мг на 1 и 2 процедурах, 60 мг на 3 и 4 процедурах и 30 мг. на последней процедуре. Улучшение состояния мы добились после первой процедуры. В последующем переведен на поддерживающую пероральную дозу преднизолона 10 мг. в сутки. В контрольном обследовании нормализация всех показателей. При повторном исследовании ФВД улучшении бронхиальной проводимости. Время пребывания в стационаре составило 21 койко-день. Стойкая ремиссия заболевания в течение 3-х месяцев по настоящее время.
Пример 3. Для сравнения приводится пример лечения больной гормонозависимой бронхиальной астмой традиционным способом. Больная Л., 42 г. Диагноз: бронхиальная астма, смешанная форма, тяжелое течение, гормонозависимая, приступный период. ДН2. Больна в течении 22 лет, по 2-3 раза в год лечится в стационаре инвалид 2-й группы последние 2 года. Принимает берликорт по 36 мг ежедневно. В настоящее время ухудшение состояния около двух недель, последнюю ночь пользовалась ингалятором более 11 раз без эффекта. Доставлена в стационар бригадой СМП. При поступлении: жалобы на приступы удушья, одышку, сухой кашель с трудноотделяемой мокротой. Приступы до 15 раз в сутки. Состояние ближе к тяжелому, обусловлено дыхательной недостаточностью. В легких по всем полям сухие свистящие хрипы. ЧДД 28 в мин. В анализах крови лейкоцитоз с лимфоцитозом, увеличение СОЭ, повышение агрегационно-адгизивных свойств тромбоцитов, увеличение содержания фибриногена. При исследовании ФВД: снижение ЖЕЛ при значительном снижении бронхиальной проводимости. Проведено лечение: беротек, теопен, панангин, гепарин, инфузионная терапия. Продолжала пероральный прием гормонов (9 таблеток берликорта), дополнительно получала гидрокортизон внутривенно капельно, ежедневно по 250 мг на протяжении 15 дней (таким образом суточная доза гормона составила примерно 100 мг в перерасчете на преднизолон). Стойкого клинического улучшения удалось добиться только на 15 день лечения. Время пребывания в стационаре составило 31 день. Выписана на поддерживающей дозе гормона 20 мг ежедневно.
Таким образом, отчетливо представлены преимущества введения глюкокортикоидов предложенным способом. При данном способе введения мы отметили более быстрое наступление стойкого клинического улучшения, уменьшение сроков пребывания больного в стационаре, значительное уменьшение курсовой и суточной дозы гормона, возможность значительно снизить поддерживающие ремиссию дозы глюкокортикоидов.
Формула изобретения
1. Способ лечения гормонозависимой бронхиальной астмы, включающий выделение аутогенной клеточной массы крови, введение в нее преднизолона, последующую инкубацию и реинфузию больному, отличающийся тем, что используют клеточную массу, включающую все клетки крови, полученную из 6-8% объема циркулирующей аутокрови с добавлением в нее 30-120 мг преднизолона и 1-2 мл раствора АТФ 100 мкг/мл.
2. Способ по п.1, отличающийся тем, что дозу гормона снижают на 20-30 мг за процедуру в зависимости от быстроты наступления и выраженности клинического эффекта.
РИСУНКИ
Рисунок 1, Рисунок 2
Источник


.jpg)