Бронхиальная астма и магнезия
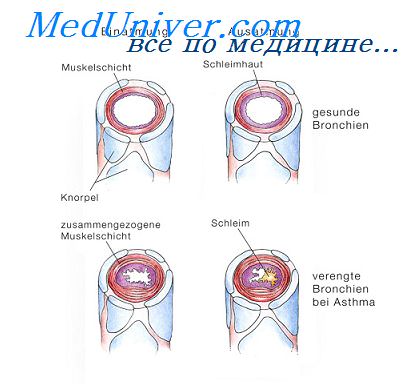
Концентрация кальция и магния при бронхиальной астме.В клинике госпитальной терапии Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова проводилось комплексное исследование метаболизма магния и его антагониста кальция у 133 больных БА. У обследованных пациентов было обнаружено достоверное снижение внутриклеточной концентрации Mg и увеличение Са наряду с уменьшением суточной экскреции магния с мочой. По данным нагрузочных тестов с сульфатом магния у больных отмечалась высокая задержка этого катиона (в среднем 54% от вводимой дозы). Полученные результаты свидетельствуют о том, что дефицит магния у пациентов с бронхиальной астмой имеет место не только в форменных элементах крови, но и в клетках, принимающих участие в развитии воспаления. Соотношение внутриклеточных концентраций кальция и магния достоверно (р Патофизиологическое значение обнаруженных нарушений клеточного гомеостаза кальция и магния, по-видимому, состоит в том, что они, создавая условия для избыточной активации свободно-радикального окисления липидов и нарушая метаболизм цАМФ, участвуют в формировании синдрома гиперреактивности бронхов. Если наряду с форменными элементами крови изменения электролитного состава имеют место и в гладких мышцах бронхов, то они сами по себе могут активировать их сокращение. Это допущение согласуется с кальциевой гипотезой астмы. При обследовании практически здоровых кровных родственников больных АБА I степени родства (родителей и детей) были обнаружены те же изменения концентрация магния и кальция в клетках крови, что и у пациентов с клинически выраженным заболеванием. По-видимому, нарушения обмена двухвалентных катионов являются генетически детерминированными и могут относиться к числу биологических дефектов практически здоровых людей, повышающих риск развития БА.
Выполненные исследования послужили основанием для назначения больным бронхиальной астмой ингаляций аэрозоля сульфата магния. Было установлено, что препарат достоверно по сравнению с плацебо снижает неспецифическую гиперреактивность бронхов и секреторную активность тучных клеток, улучшая непосредственные и отдаленные результаты лечения больных бронхиальной астмой атопического генеза и физического усилия. Таким образом, нарушения минерального обмена, по-видимому, являются одним из механизмов формирования синдрома гиперреактивности бронхов и бронхообструктивного синдрома у пациентов с бронхиальной астмой. Помимо ионов калия, натрия, кальция и магния, в регуляции бронхиальной проходимости и различных фаз реакций гиперчувствительности принимают, вероятно, микроэлементы (МЭ). В исследованиях, выполненых in vitro и in vivo, установлено, что наиболее чувствительны к дефициту меди и цинка Т-киллеры и Т-хелперы, макрофаги и нейтрофилы, в меньшей степени — В-лимфоциты. У экспериментальных животных, получавших диету с низким содержанием данных МЭ, и у больных с генетически детерминированными нарушениями обмена меди и цинка наблюдалось развитие Т- и В-иммунодефицитов, проявляющихся инфекционными поражениями внутренних органов, в том числе и легких. Селективный дефицит цинка приводил к гипоплазии тимуса, снижению активности тимолина и развитию Т-клеточного иммунодефицита. Полученные данные, вероятно, можно объяснить тем, что цинк регулирует синтез нуклеиновых кислот, активной формы тимолина и стимулирует Т-лимфоциты. При изучении показателей обмена микроэлементов у больных затяжной пневмонией найдено снижение концентрации важнейших биоэлементов, в том числе меди и цинка, в сыворотке крови, сочетающееся с Т-и В-клеточным дисбалансом и депрессией ферментов метаболизма ксенобиотиков. Коррекция содержания МЭ с помощью препаратов растительного происхождения увеличивала эффективность действия иммуномодуляторов и способствовала более быстрому восстановлению иммуноэнзиматического статуса. На основании полученных результатов сделан вывод о том, что изменение микроэлементного состава крови является одной из причин формирования вторичных иммунодефицитных состояний при заболеваниях органов дыхания. В серии исследований продемонстрировано дозозависимое торможение физиологическими концентрациями цинка Ig Е-опосредованного освобождения гистамина и лейкотриена С4 из тучных клеток и базофилов. По мнению авторов, ионы Zn, депонированные в гранулах мастоцитов, выделяются в процессе секреции медиаторов, выполняя роль регулятора по принципу отрицательной обратной связи. Полученные результаты обусловлены мембраностабилизирующим эффектом цинка, способностью этого катиона «маскировать» рецепторы для Ig E на поверхности тучных клеток, инактивировать фосфолипазу А2, а также его конкурентный антагонизм с кальцием. Последним объясняется устранение экспериментального аллергического бронхоспазма добавками солей Zn. Таким образом, результаты цитируемых выше исследований свидетельствуют о том, что МЭ участвуют в регуляции клеточного и гуморального звеньев иммунитета, процесса сенсибилизации, интенсивности патохимической и патофизиологической стадий аллергических реакций немедленного типа, которым принадлежит существенная роль в формировании воспалительных изменений бронхов и легких. Заслуживают внимания данные о способности МЭ контролировать активность перекисного окисления липидов (ПОЛ) и антиоксидантной защиты. Известно, что медь, цинк и марганец входят в состав супероксиддисмутазы, селен-глютатионпероксидазы. Эти ферменты являются компонентами внутриклеточной антирадикальной системы. Церулоплазмин, один из основных внеклеточных антиоксидантов, относится к классу медьсодержащих протеинов. Цинк, образующий химические связи с сульфгидрильными группировками белков, фосфатными остатками фосфолипидов и карбоксильными группами сиаловых кислот, обладает мембраностабилизирующим действием. Избыток ионизированного железа оказывает прооксидантное действие. Дефицит меди и цинка приводит к накоплению свободных радикалов в тканях. Таким образом, нарушение обмена МЭ является одним из факторов, способствующих избыточной активации ПОЛ, участвующей в формировании воспаления бронхов и бронхиальной обструкции у больных бронхиальной астмой и хронической обструктивной болезнью легких. — Также рекомендуем «Роль меди в развитии эмфиземы легких и бронхиальной астмы.» Оглавление темы «Болезни легких при нарушениях обмена.»: |
Источник
Фактически любому больному, поступающему в отделение интенсивной терапии с обострением бронхиальной астмы (БА), специалисты ставят диагноз «астматический статус». Такие нормы прописаны в МКБ –10, но это не позволяет объективно судить о тяжести процесса. Стоит помнить, что диагноз «астматический статус» (АС) – это собирательное понятие, которое объединяет разной степени тяжести обострения астмы. Некоторые специалисты предполагают, что термин «АС» в ближайшие годы перестанет быть актуальным. В рекомендациях по лечению БА объединения GINA (Global Initiative for Asthma) «астматический статус! не упоминается.
А ведь именно эти документы явились основой для отечественных рекомендаций по лечению БА. Правильное определение доктором степени тяжести обострения бронхиальной астмы дает возможность оптимизировать лечение, обнаруживать больных, которые требуют к себе максимального внимания.
- Обследование и мониторинг
- Лечение обострения бронхиальной астмы
- Дозированные аэрозольные ингаляторы
- Кортикостероиды
- Магния сульфат
- Респираторная терапия
По данным, которые приводят эксперты GINA, Россия занимает первое место в мире по летальности вследствие БА. Некоторые исследователи говоря, что это связано это не только с качеством оказываемой помощи, но, скорее, с неправильной диагностикой этой болезни. Часто врачи за БА принимают хроническую обструктивную болезнь легких (ХОБЛ). Как известно, длительно существующая БА – одна из главных причин хронической обструктивной болезни легких. Когда возраст пациента с БА 60 лет и более лет, медики не сделают ошибки, если отразяи ХОБЛ в диагнозе.
Если возраст больного не выше35-40 лет, диагноз ХОБЛ можно исключить. Проблема дифференциальной диагностики у людей в возрасте 40 и более лет усложняется тем, что может одновременно наблюдаться БА и ХОБЛ. Но часто проявления ХОБЛ, даже если пациент никогда не болел бронхиальной астмой, принимают за обострение БА. Это самый плохой случай, потому что лечение этих заболеваний существенно отличается.
Также очень сильно эти болезни различаются исходами. Для ХОБЛ характерно прогрессирование заболевания и отсутствие обратимости. Для БА типична обратимость, хорошая положительная динамика на правильно проводимое лечение, волнообразное течение. Стоит учитывать: если обострение БА не поддается той терапии, о которой пойдет речь ниже, с большой вероятностью основная патология – это ХОБЛ.

Причины обострения бронхиальной астмы
Чаще всего пусковой причиной являются вирусные, реже – бактериальные инфекции, неблагоприятные условия внешней среды, различные аллергены, погрешности в терапии диагностированной астмы.
Обследование и мониторинг
Всем больным делают рентгенографию легких. Контролируется артериальное давление, ЧСС, газы крови, ЭКГ, пиковая скорость выдоха (ПСВ), электролиты крови, гематокрит, глюкоза, креатинин, сатурация крови. Также проводится динамическая оценка клинических симптомов.
Врачи определяют тяжесть обострения по таблице:
Тяжесть обострения БА | |||||||||
Признак | Легкое | Средней тяжести | Тяжелое | Потенциально фатальное | |||||
Одышка | При ходьбе | При разговоре | В покое | ||||||
Речь | Предложениями | Фразами | Словами | ||||||
Свистящие хрипы | Часто только на выдохе | Громкие | Часто громкие | Отсутствуют | |||||
Положение | Могут лежать | Предпочитают сидеть | Сидят, наклонясь вперед | ||||||
Уровень бодрствования | Иногда возбужден | Обычно возбужден | Обычно возбужден | Заторможен или спутанное сознание | |||||
Участие вспомогательных мышц в акте дыхания и западение надключичных ямок | Обычно есть | Обычно есть | Парадоксальные движения грудной и брюшной стенок | ||||||
ЧСС | <100 | 100-120 | Более 120 | Брадикардия | |||||
ЧДД | Увеличена | Увеличена | >30 | ||||||
ПСВ* измерить через 30-60 минут после первого введения бронхолитика в % от должного или наилучшего индивидуального зна-чения | Более 80% от должных или наилучших индивидуальных значений | 60-80% от должных или наилучших индивидуальных значений | <60% от должных или наилучших индивидуальных значений (<100 л/мин у взрослых) или эффект длится менее 2 ч | ||||||
SpO2, % (при дыхании воздухом) | 91-95% | Менее 90% | Менее 90% | ||||||
РаO2 (при дыхании воздухом) | Больше 60 мм рт. ст. | Меньше 60 мм рт. ст. Возможен цианоз | Цианоз | ||||||
РаСO2 | Менее 45 мм рт. ст. | Более 45 мм рт. ст. | |||||||
*Примечание. Ориентировочные значения пиковой скорости выдоха у здоровых взрослых мужчин – 500-600 л/мин, женщин – 350-500 л/мин. | |||||||||
Лечение обострения бронхиальной астмы
При любой тяжести обострения БА назначают кортикостероиды и ингаляционные бета-2-агонисты. Лечение проводить в таком порядке:
- Оксигенотерапия
Больной занимает вынужденное сидячее или полусидячее положение. Лечащий врач должен предупредить медсестер палаты, чтобы они не пытались укладывать больного в положение «лежа».
Гипоксия – основная причина смерти при обострениях астмы. Поэтому, если у человека отмечают гипоксемию, нужно как можно скорее назначить кислород. Медики регулируют скорость подачи кислорода, чтобы обеспечить уровень SpO2 более 92 %. Даже высокие концентрации кислорода (FiO2> 0,7) в дыхательной смеси только несущественно повышают РаСO2 и не приводят к угнетению дыхательного центра.
Начать оксигенотерапию рекомендуется, используя носовые катетеры со скоростью 1-6 литра в минуту или через кислородную маску. Нужно обеспечить венозный доступ, используя периферические венозные катетеры.
- Ингаляционные бронходилататоры
Стоит помнить, что для ингаляционного введения бронходилататоров с одинаковой эффективностью можно применить как небулайзер, так дозированные аэрозольные ингаляторы. Ингаляционные бронходилататоры выбирают для лечения обострения бронхиальной астмы любой тяжести. В большинстве случаев можно давать больному только бета-2-агонисты.
При тяжелом течении нужны ингаляции бета-2-агонистов вместе с холинолитиками, магния сульфатом. Рекомендуется использовать комбинацию бета-2-агониста + холинолитик (ипратропиума бромид) при тяжелом обострении БА; при недостаточном эффекте от проводимого лечения бета-2-агонистами; у пациентов в возрасте более 60 лет, и в любом возрасте, если врачом отмечены признаки ХОБЛ у больного.
Если пациент до поступления в ОРИТ не принимал по назначению врача бета-2-агонисты, или получал их в обычных дозах, то лучше всего продолжать ингаляцию того бета-2-агониста, который ранее был наиболее эффективен для лечения этого больного (спросить у него самого или родственников).
- Использование небулайзера
Процедура ингаляции лекарственных средств через небулайзер занимает большое количество времени, а гипоксемия у больных встречается часто, поэтому рекомендуется использовать небулайзер с пневмоприводом от кислородной магистрали.
Чаще берут специальные растворы для ингаляций:
Сальбутамол – селективный агонист бета-2-адренорецепторов. Способ применения: с помощью небулайзера; небула по 2,5 мл, которая содержит 2,5 мг сальбутамола в физиологическом растворе. Назначают 1-2 небулы (2,5-5,0 мг) на ингаляцию в неразбавленном виде. Если улучшения не фиксируется, врачи проводят повторные ингаляции по 2,5 мг каждые 20 минут в течение одного часа. После этого 2,5-10 мг через 1-4 ч по необходимости или 10-15 мг в час постоянно.
Беродуал – 1 мл (20 капель) раствора для ингаляций содержит 500 мкг фено-терола гидробромида и 250 мкг ипратропиума бромида. Следует ингалировать 1 мл (20 капель) беродуала в 3-4 мл физиологического раствора или 25% растворе магния сульфата на проятжении 5-10 мин, до полного использования раствора. Если улучшения нет, нужна повторная ингаляция через 20 минут.
Медики помнят, что магния сульфат демонстрирует свойства бронходилататора как при внутривенном введении, так и при ингаляциях. Хотя препарат и несколько уступает по эффективности как бета-2-агонистам, так и холинолитикам. Но если 5-8 мл 25% магния сульфата использовать вместо натрия хлорида 0,9% в качестве растворителя для бета-2-агонистов, можно наблюдать более выраженный совместный брохолитический эффект.
Ипратропиума бромид через небулайзер: 0,5 миллиграмм каждые 20 минут до 3 доз, после этого по необходимости. Для этого лекарстваа при ингаляционном способе введения типична крайне низкая абсорбция со слизистой дыхательных путей, и потому он не оказывает системного действия.
Дозированные аэрозольные ингаляторы
Для эффективного использования дозированных ингаляторов, важно чтобы они были оснащены спейсером, предпочтительно большого объема (0,5-1 литр), потому что некоторым людям трудно согласовать свой вдох с ингаляцией. Если спейсера нет, его можно изготовить довольно быстро из обычной пластиковой бутылки или любой другой подходящей емкости.
При обострении бронхиальной астмы назначаются бета-2-агонисты короткого действия – тербуталина сульфат (1 доза – 250 мкг), сальбутамол (1 доза – 100 мкг), фенотерол гидробромид (1 доза – 200 мкг), Беродуал (одна доза беродуала содержит 0,05 мг фенотерола и 0,02 мг ипратропиума бромида). Вначале пациент с интервалом в несколько секунд между ингаляциями последовательно вдыхает от четырех до восьми доз одного из перечисленных выше лекарств. После — по 1-2 дозы через 10-20 минут до улучшения состояния или появления побочных явлений – тахикардии, выраженного тремора. После этого по необходимости – 1-2 дозы через 1-4 ч.
Ингаляция ипратропиума бромида через дозированный ингалятор – 8 вдохов каждые 20 минут, если возникает необходимость, то повторять на протяжении 3 часов.
Осложнения
При использовании бета-2-агонистов следует учесть противопоказания к ним: нарушения ритма сердца, выраженная гипертензия и прочие. Также нужно контролировать концентрацию калия в плазме – может развиться гипокалиемия. Если у больного отмечается появление признаков передозировки бета-2-агонистов, нужно сразу прекратить вводить их. Но через 4-5 часов необходимо прием лекарств начинают снова. Пациенты с обострением БА должны принимать указанные препараты, пока не появится стойкое улучшение состояния.
Кортикостероиды
Важно учесть: кортикостероиды назначают всем больным с обострением бронхиальной астмы вне зависимости от степени тяжести, и сразу же после поступления, не откладывая. Значительную роль в развитии обострения астмы играет не только бронхоспазм, но и воспаление, отек, дискинезия мелких дыхательных путей и закупорка их вязкой мокротой. Поэтому кортикостероиды, которые оказывают выраженное противовоспалительное действие, важны для лечения астмы. Кортикостероиды можно назначать как внутривенно, так и энтерально, эффект будет одинаков по силе.
Клинически значимый эффект после их введения развивается через 2-4 часа: в среднем, через 1-6 часов при внутривенном ведении. При энтеральном приеме – чуть позже. Исследования говорят, что относительно низкие дозы кортикостероидов (метилпреднизолон 40-80 мг в сутки) так же эффективны, как и относительно высокие дозы метилпреднизолона – 200-300 мг/сут. Не доказано, что применение сверх высоких доз (пульс-терапия) преднизолона (1-2 г в сутки), может улучшить результаты терапии. Т.е имеет место своеобразный пороговый эффект.
Пациентам с легким и среднетяжелым обострением можно приписать энтеральный или ингаляционный способ введения. Метод выбора – метилпреднизолон или преднизолон энтерально в дозе в 60-80 мг в сутки за 1-3 приема. При тяжелом, или потенциально фатальном обострении астмы, лучше всего прибегать к внутривенному пути введения кортикостероидов.
Большинство специалистов выбирают дозу 1,5-2 мг/кг в сутки преднизолона в/в, разделенную на 4 приема. На следующий день введение препарата следует повторить – в аналогичной дозе и с той же частотой введения. В следующие дни дозировку преднизолона нужно снизить – по 60-90 мг в сутки внутривенно или энтерально в течение 5-7 суток или до стойкой стабилизации состояния человека.
Вместо преднизолона с фактически такой же эффективностью можно приписать дексаметазон по 4 мг в/в 3 раза в сутки, или гидрокортизон 125-250 мг внутривенно 4 раза в сутки. Если сравнивать с с преднизолоном, то дексаметазон обладает большей продолжительностью биологического действия. По этой причине продолжительность курса может составлять всего лишь 4-5 суток. Дозу не нужно постепенно снижать. Стоит помнить: при тяжелом обострении ингаляционные кортикостероиды медики назначают только после стойкого улучшения состояния пациента.
Магния сульфат
Внутривенное назначение магния сульфата вошло во все рекомендации в качестве терапии второго плана, как у взрослых пациентов, так и детей. Магния сульфат назначается в случае недостаточного эффекта от применения бета-2-агонистов; при тяжелом обострении бронхиальной астмы, при котором есть выраженная бронхообструкция.
Перед назначением магния сульфат гиповолемию нужно обязательно ликвидировать, САД должно быть выше 100 мм рт. ст. Важно: если у человека потенциально летальное обострение, то назначают магния сульфат только после перевода человека на управляемое дыхание и стабилизации гемодинамики.
Большинство специалистов советуют введение 2 г магния сульфата за 20 минут. По субъективному мнению части исследователей, эффективной является такая методика введения магния сульфата: 20 мл 25% раствора (5 грамм) вводят внутривенно за 15-20 минут, потом в/в инфузия со скоростью 1-2 г в час до ликвидации явлений бронхоспазма. При этом, как утверждают исследователи, они ни разу не наблюдали повышения уровня магния в крови выше терапевтического уровня – 2-4 ммоль на литр. Назначение сульфата магния должно быть остородным, если у человека зафиксированы явления почечной недостаточности или же гипотония.
Дополнительные методы лечения бронхоспазма
Рутинно указанные ниже препараты не назначаются. Если нет ингаляционных бронходилататоров, достаточного эффекта от ингаляционной терапии или пациент не в состоянии ее выполнять эффективно, врачи используют внутривенное введение бета-2-агонистов: сальбутамол (нагрузочной и поддерживающей дозой), эпинефрин (Адреналин). На сегодня медики не применяют для терапии обострения БА аминофиллин (Эуфиллин), потому что он вызывает ряд серьезных побочных эффектов, включая тремор, тахикардию и жидкий стул.
Кроме медикаментозной терапии, многим больным требуется и ИВЛ.
У некоторых исследователей вызывает большие сомнения целесообразность применения НИВЛ у больных с фатальным обострением бронхиальной астмы. Но по мнению энтузиастов, применяющих этот метод при астматическом статусе, во многих случаях удавалось избежать интубации трахеи и проведения инвазивной ИВЛ.
Лучше всего перед самым началом ИВЛ провести инфузию солевых растворов в объеме 400-800 мл для уменьшения риска развития гипотонии. После интубации и начала искусственной вентиляции легких, из-за перераздувания альвеол, повышения внутригрудного давления и высокого ауто-ПДКВ высока вероятность резкого снижение наполнения кровью правого желудочка. Следствием будет развитие гипотонии. Нужно для оказания незамедлительной первой помощи заранее приготовить рабочий раствор катехоламина (обычно – эпинефрина (Адреналина) – 1мг эпинефрина развести в 10,0 0,9% натрия хлорида). В случае гипотензии рекомендуется вводить в/в по 0,5-1 мл.
Преоксигенация. Интубацию трахеи лучше всего производить на фоне 100% ингаляции кислорода. Для снижения сопротивления выдоху, медики используют эндотрахеальную трубку наибольшего для данного человека диаметра.
Индукцию осуществляют кетамином – 1-2 мг на 1 кг тела больного или пропофолом – 1-3 мг/кг. Для седации в первые 2-4 часа лучше всего использовать инфузию кетамина 2-4 мг/кг/час, поскольку он имеет более выраженное брохолитическое действие по сравнению с другими гипнотиками. После некоторой стабилизации больного и уменьшения бронхоспазма с целью седации обычно используется инфузия кетамина, пропофола или их смесь (кетофол).В качестве миорелаксанта для интуба-ции применяют оыбчно сукцинилхолин 1,5 мг/кг.
Продолжительность ИВЛ составляет для большинства пациентов с потенциально фатальным обострением 3-8 часов и обычно не проводится дольше 2-3 суток. Критерии перевода больного на спонтанное дыхание традиционные: стабильная гемодинамика, ясное сознание пациента, давление на вдохе в системе респиратор-больной менее 25 мм вод. ст., РаO2 больше 65 мм рт. ст., SpO2 более 90% при FiO2 30-40%., есть самостоятельное дыхание человека.
Этот метод актуален, если больной не может самостоятельно пить воду, или врач фиксирует признаки дегидратации, гипотонию. У пациентов часто имеет место правожелудочковая недостаточность, поэтому гиперволемия и большие объемы жидкости противопоказаны.
Инфузию с использованием стандартных солевых растворов проводят: перед началом ИВЛ, в объеме 2-3 литра в сутки внутривенно во время ИВЛ, если зондовое введение пищи и жидкости не проводится.
Источник