Генетические маркеры бронхиальной астмы
Обсуждается генетический компонент развития бронхиальной астмы. Гены-кандидаты расположены на хромосомах 2, 4, 7, на кластере цитокинов, на хромосоме 5 и на хромосоме 6 в области MHC.
Genetics of bronchial asthma
Authors discussed genetic component development of bronchial asthma. Candidate genes located on chromosomes 2, 4, 7, on a cluster of cytokines, on chromosome 5 and on chromosome 6 in the MHC.
Бронхиальная астма (БА) — заболевание с выраженной наследственной предрасположенностью. Дети, имеющие родственников первой линии родства с БА, имеют высокий риск развития клинических проявлений астмы [1]. Некоторые клиницисты большое внимание уделяют признакам мезенхимальной дисплазии как внешним маркерам генетических особенностей. У пациентов с БА часто встречаются множественные стигмы дисморфогенеза, патология соединительной ткани, кожные факомы. По итогам близнецовых исследований, генетический вклад в развитие БА оценивается в 30-70%.
Таблица 1.
Риск атопии у пробанда при достижении им возраста 7 лет в зависимости от наличия атопии в семейном анамнезе
| Семейный анамнез | Риск развития атопии (%) |
| Нет атопии | 10 |
| Один из родителей страдает атопией | 20 |
| Сиблинги страдают атопией | 35 |
| Оба родителя страдают атопией, но разными вариантами | 42 |
| Оба родителя страдают атопией, клиническая форма идентична | 75 |
БА — типичное заболевание мультифакториальной природы, развитие которого определяется взаимодействием наследственных факторов (мутаций или сочетаний аллелей) и факторов среды.
В последние годы генетические исследования при астме ведутся по нескольким направлениям: выявление вариантов генов, которые могут предсказать ответ на терапию, выявление вариантов генов, которые связаны с развитием болезни и играющих решающую роль в патофизиологии заболевания.
Верифицированы несколько групп генов-кандидатов, которые важны в развитии БА.
Гены атопии или гуморального иммунного ответа локализованы в участках хромосомы 5q24-33 и содержат кластер семейства генов цитокинов (IL-4, IL-5, IL-13, IL-3, GM-CSF), ответственный за развитие реакций немедленного типа (IgE-опосредованных реакций). IL-4, IL-13 экспрессируются Th-2 лимфоцитами и способствуют переключению В-клеток на синтез IgE. IL-5 и GM-CSF — цитокины, обеспечивающие созревание, выживание и хемотаксис эозинофилов. К этой группе также относят HLA-DR (гены молекул II класса МНС) — важные молекулы, участвующие в презентации антигена. Имеющиеся сегодня данные свидетельствуют, что полиморфизм генов интерлейкинов и их рецепторов является важным генетическим фактором возникновения БА и атопии [2, 3].
Гены рецепторных молекул (IL-4Rα, FcεRI β, ADRβ2). IL-4Rα — альфа цепь рецептора IL-4. Mitsuyasu et al. [4] сообщили о полиморфном варианте гена Ile50Val IL-4Rα цепи, наличие которого повышает синтез IgE и является одним из определяющих наследственных факторов возникновения атопической формы заболевания. В 17% случаев замена одного аминокислотного остатка (изолейцина лейцином в позиции 181) в гене, кодирующем β-субъединицу высокоаффинного рецептора к IgE (FcεRI β), приводит к развитию бронхиальной астмы. Однако аналогичные исследования, проведенные в Италии и Японии, такой закономерности не выявили.
Продукт ADRβ2 (гена β2-адренергического рецептора; 11q13) контролирует лабильность бронхов. Установлен полиморфизм гена ADRβ2 (Arg16Gly и Glu27Gln), определяющий повышенную вероятность развития тяжелой бронхиальной астмы. Более того, больные гомозиготные по этим вариантам гена быстро теряют чувствительность к β2-агонистам и требуют лечения гормональными препаратами [5]. Это является одним из достижений в фармакогенетике БА. Причем ген рецептора IL-4 (IL4RA) и ген, кодирующий β-субъединицу высокоаффинного рецептора к IgE (FcεRI β), могут быть отнесены к генам атопии, а ген ADRβ2 — к генам бронхиальной гиперреактивности.
Южнокорейскими учеными [6] выявлены 2 полиморфных гена CRTH2, экспрессирующихся на поверхности эозинофилов, с однонуклеотидными заменами -466T>C и -129C>A, которые тесно связаны с инфильтрацией эозинофилами дыхательных путей у больных с аспирин-индуцированной БА. Гены факторов транскрипции — STAT6, JAK1, JAK3 [7] ассоциированы с наличием БА. Последний мета-анализ объединил результаты 11 исследований [8]. Выявлены хромосомные регионы, содержащие ведущие гены восприимчивости к БА, при использовании самых строгих статистических критериев. К ним относятся 6p22.3-p21.1 (гиперактивность бронхов), 5q11.2-q14.3 и 6pter-p22.3 (концентрация общего IgE), 3p22.1-q22.1, и 17p12-q24.3 (положительный кожный тест). Однако никакой преобладающей ассоциации среди указанных регионов не обнаружено, что объясняет гетерогенность болезни и вариабельность диагноза в разных популяциях разных стран.
Признано, что многочисленные гены взаимодействуют между собой при БА и атопии, повышая или уменьшая риск развития болезни. При наличии генов, кодирующих IL-13 и IL-4RA (обе ключевые молекулы в Th-2 сигнализации), выявлен в 2,5 раза больший риск развития БА, чем у индивидуумов с наличием одного гена. Исследование четырех генов показало, что комбинация определенного однонуклеотидного полиморфизма (SNPs) в IL-13, IL-4, IL4RА, и STAT 6 сопровождается 16,8-кратным увеличением риска БА. Эти сведения указывают на значение изучения взаимодействия генов при сложных болезнях и объясняют их роль в развитии и прогрессировании болезни.
Имеется предположение, что эндогенная БА — аутоиммунное заболевание, опосредованное аутоантителами к эпителиальному антигену. Не исключено, что появление аутоантител связано с генетически обусловленным дефицитом антиоксидантной системы. Свободные радикалы способны превращать макромолекулы в аутоантигены. На их возникновение иммунная система отвечает выработкой специфических аутоантител. В организме запускается аутоиммунный процесс, который в конечном итоге и приводит к БА. В этой связи относительно недавно обнаружена субпопуляция T-хелперов, названная Th17 [9], играющая значимую роль при аутоиммунных заболеваниях.
IL-17 является эффекторным цитокином, который продуцируют Th17 клетки, и его повышенная концентрация выявлена в слюне больных БА [10]. Однако имеются исследования [11] о варианте гена IL-17, His161Arg, который ассоциирован с протективным эффектом при астме. В 2009 году обнаружены новые гены восприимчивости к БА, не связанные с иммунной системой. Полиморфизм генов хитиназы и хитиназоподобных белков CHIT1, CHIA, CHI3L1 сочетается с риском БА.
Относительно недавно был охарактеризован первый позиционно клонированный ген астмы ADAM33 [12] на хромосоме 20p13. Анализ 135 однонуклеотидных полиморфизмов в 23 из них показал наиболее существенную ассоциацию заболевания с вариантом гена ADAM33, который кодирует металлопротеазу, играющую важную роль в функционировании гладких мышц бронхов и фибробластов легкого. Эти данные свидетельствуют о важной роли ADAM33 в ремоделировании дыхательных путей. В настоящее время роль этих генетических вариаций, связанных с восприимчивостью к астме, подтверждена в Саудовской Аравии, Китае [13]. В локусе хромосомы 1q31 в 2010 году был идентифицирован ген DENND1B, который экспрессируется натуральными киллерами и дендритными клетками, кодирует белок, взаимодействующий с рецептором фактора некроза опухоли, и связан с развитием БА [14].
Гены-модификаторы (GSTM1, GSTT1, CYP2E1, NAT2, SLC11A1). На сегодняшний день известно, что в патологии БА принимают участия белковые продукты генов системы детоксикации ксенобиотиков. Недавними исследованиями Сардарян И.С. [15] изучены фенотипические особенности БА при аллельном полиморфизме генов глутатион-S-трансферазы Т1 (GSTT1), глутатион-S-трансферазы М1 (GSTM1), ангиотензин превращающего фермента (ACE), эндотелиальной синтазы оксида азота (eNOS). Выявлено, что ассоциация генотипов GSTT1-GSTM1‑ повышает в 5 раз риск развития БА у детей по сравнению с популяцией. У детей при функционально активном генотипе GSTT1+GSTM1+ в ассоциации с полиморфизмом II по гену АСЕ риск развития БА снижается в 7 раз, что позволяет считать данную ассоциацию генотипов протективной.
В заключение можно указать, что к развитию астмы причастны много генов, расположенных на разных хромосомах. Прежде всего это генный комплекс HLA на 6-й хромосоме. Кроме того, с развитием БА связаны:
- локусы 2 pter*
- 2q6 (реакция на домашних клещей)
- 2q33 (CD28; белок, связывающий инсулиноподобный фактор)
- 3p24.2-p22 (С-С рецептор хемокина)*
- 4q35 (интерферонорегулирующий фактор-2)*
- 5q15 (ген не идентифицирован)
- 5q23-q33 (IL-3; IL-4; IL-5; IL-9; IL-13; глюкокортикоидный рецептор)**
- 5q31 (гены регуляции IgE). В непосредственной близости расположены гены бронхиальной гиперреактивности и адренергических b2 рецепторов
- 6p21.1-p23 (HLA, фактор некроза опухолей α)*
- 7р15.2 (Т-клеточный рецептор G, IL-6)*
- 9q31.1 (тропомиозин связывающий белок)*
- 11р15 (ген не идентифицирован)
- 11q13 (ген b-цепи высоко аффинного IgE рецептора, триггер аллергических реакций на мастоцитах, передается по материнской линии, отцовский «импринтинг» вероятен)**
- 12q (синтаза оксида азота)
- 12q14-q24.33 (сигнальный кондуктор и активатор транскрипции 6; интерферон γ; фактор стволовых клеток; инсулин-подобный фактор роста 1; лейкотриен А4 гидролаза; β субъединица ядерного фактора Y; В-клеточный транслокационный ген 1)**
- 13q14.3-qtep (трансляционно контролируемый протеин-1 опухоли)*
- 16q22.1-q24.2 (ген не идентифицирован)
- 17p11.1-q11.2 (хемокиновый кластер)
- 19q13 (CD22)
- 21q21 (ген не идентифицирован)
- Xq28/Yq28 (рецептор IL-9)
—————————————————
Примечание:
* — общие гены с атопией; ** — общие гены с атопией и атопическим дерматитом
Данный перечень генов, ответственных за развитие БА, не полон. Не упомянуты гены, участвующие в ремоделировании дыхательных путей, гетерогенна и гиперреактивность дыхательных путей. Все это делает понятным клинический полиморфизм заболевания.
Будет ли возможно в будущем предсказать развитие БА, базируясь на генетическом тестировании? Предсказующая величина тестирования единственного гена при полигенном наследовании болезни очень ограничена как для диагностики, так и в профилактических целях. В будущем прогноз астмы, возможно, будет основываться на оценке комплекса генов, персональных факторов и факторов риска окружающей среды, вместе содействующих развитию, персистенции, прогрессированию или ремиссии БА [16, 17].
Ю.И. Будчанов, В.М. Делягин
Тверская государственная медицинская академия
Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии, г. Москва
Будчанов Юрий Иванович — кандидат медицинских наук, доцент кафедры клинической иммунологии с аллергологией Тверской государственной медицинской академии.
Литература:
1. Burr M., Merrett T., Dunstan F., Maguire M. The development of allergy in high-risk children // Clinical and Experimental Allergy, 1997. — v. 27. — Р. 1247-1252.
2. Фрейдин М.Б., Огородова Л.М., Пузырев В.П. Вклад полиморфизма генов интерлейкинов в изменчивость количественных факторов риска атопической бронхиальной астмы // Мед. генетика, 2003. — Т. 2. — № 3. — С. 130-135.
3. Фрейдин М.Б., Брагина Е.Ю., Огородова Л.М., Пузырев В.П. Генетика атопии: современное состояние. // Вестник ВОГиС, 2006. — Том 10. — № 3 — С. 492-503.
4. Mitsuyasu H., Izuhara K., Mao X.-Q. et al. Ile50Val variants or IL4Ra upregulates IgE synthesis and associates with atopic asthma // Nat. genet., 1998. — v. 19. — Р. 119-120.
5. Wechsler M., Lehman E., Lazarus S. et al. National Heart, Lung and Blood Institute’s Asthma Clinical Research Network. beta-Adrenergic receptor polymorphisms and response to salmeterol //American Journal Respir. Crit. Care Medicine, 2006. — v. 173. — P. 519-526.
6. Palikhe N., Kim S-H., Cho B-Y. et al. Genetic variability in CRTH2 polymorphism increases eotaxin-2 levels in patients with aspirin exacerbated respiratory disease // Allergy, 2010. — v. 65. — Р. 338-346.
7. Moller M., Gravenor M., Roberts S. et al. Genetic haplotypes of Th-2 immune signalling link allergy to enhanced protection to parasitic worms. // Human Molecular Genetics, 2007. — v. 16. — Р. 1828-1836.
8. Denham S., Koppelman G, Blakey J. et al. Meta-analysis of genome-wide linkage studies of asthma and related traits // Respir. Research, 2008. — v. 9. — р. 38.
9. Weaver C., Hatton R., Mangan P., Harrington L. IL-17 family cytokines and the expanding diversity of effector T cell lineages // Annual Revy Immunology, 2007. — 25. — Р. 821-852.
10. Bullens D., Truyen E., Coteur L. et al. IL-17 mRNA in sputum of asthmatic patients: linking T cell driven inflammation and ranulocytic influx? // Respir. Res., 2006. — v. 7. — Р. 135.
11. Kawaguchi M., Takahashi D., Hizawa N. et al. IL-17F sequence variant (His161Arg) is associated with protection against asthma and antagonizes wild-type IL-17F activity // Journal of Allergy and Clinical Immunology, 2006. — v. 117. — Р. 795-801.
12. Van Eerdewegh P., Little R., Dupuis J. et al. Association of the ADAM33 gene with asthma and bronchial hyperresponsiveness // Nature, 2002. — v. 418. — Р. 426-430.
13. Bazzi M., Al-Anazi M., Al-Tassan N.A. et al. Genetic variations of ADAM33 in normal versus asthmatic Saudi patients // https://biotechcentersa.org/asthma-genetics/.
14. Sleiman P., Flory J., Imielinski M. et al. Variants of DENND1B associated with asthma in children // New England Journal of Medicine, 2010. — v. 362. — Р. 36-44.
15. Сардарян И.С. Фенотипические особенности бронхиальной астмы у детей при различных аллельных полиморфизмах генов «предрасположенности» (GSTТ1, GSTМ1, ACE, eNOS) / Автореф. дисс. к.м.н. — СПб, 2009. — 22 с.
16. Koppelman G., te Meerman G., Postma D. Genetic testing for asthma // Eur. Respir. J., 2008. — v. 32. — Р. 775-782.
17. Postma D., Koppelman G. Genetics of asthma: where are we and where do we go? // The Proceedings of the American Thoracic Society, 2009. — v. 6. — Р. 283-287.
Источник
Название болезни в переводе с греческого языка означает «удушье». Бронхиальная астма — удушье по причине спазма бронхиол. Их воспаление происходит без инфекционного агента, поэтому невозможно заразиться бронхиальной астмой. Заболевание имеет хроническое течение, периоды ремиссии сменяются обострениями, которые часто носят сезонный характер.
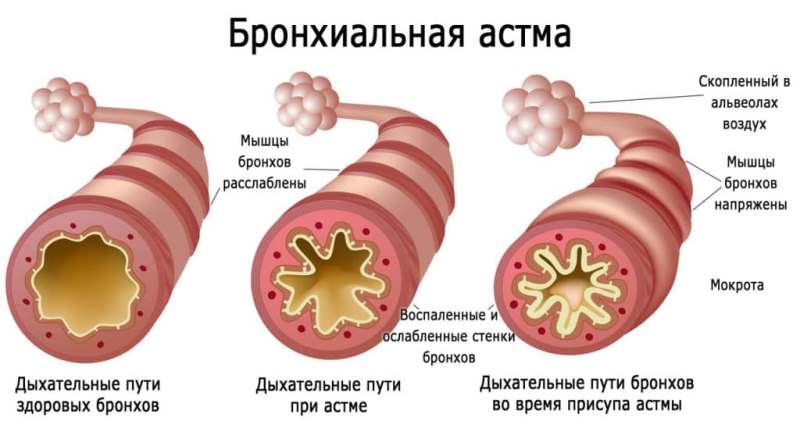
Причины развития бронхиальной астмы
Приступы удушья провоцируются воздействием аллергенов на рецепторы бронхиол. В большинстве случаев развитие бронхиальной астмы обусловлено мутацией гена, кодирующего адренергический рецептор. Происходит замена одного аминокислотного остатка — в позиции «16» аргинин замещает глицин. В результате усиливается реакция мелких бронхиол на влияние раздражителя — триггера, запускающего иммунную реакцию по гиперергическому типу.

Раздражение рецепторов приводит к активации иммунных клеток, выделяющих медиаторы воспаления, под действием которых происходит спазм мышечной оболочки бронхиол и усиливается секреция эпителиальных клеток. Во время приступа бронхиальной астмы создается парадоксальная ситуация: при полном заполнении легких ощущается острая нехватка кислорода.
Триггеры при бронхиальной астме:
- бытовые аллергены — пылевые клещи, шерсть домашних животных;
- сезонные природные факторы — пыльца растений, в том числе берез;
- продукты питания;
- косметика;
- лекарственные средства — ингибиторы ЦОГ1 и ЦОГ2 — нестероидные противовоспалительные препараты (аспириновая бронхиальная астма);
- производственная пыль и взвеси, в том числе лакокрасочных материалов.
Формы бронхиальной астмы:
- атопическая — аллергенная;
- неаллергическая — вызывается анатомическими изменениями бронхов вследствие первичного поражения слизистой оболочки бронхиального древа;
- смешанная.
Неаллергическая бронхиальная астма развивается на фоне длительно текущего бронхита как инфекционной, так и неинфекционной природы. Последнее провоцируется следующими вредными факторами:
- табачным дымом;
- ожогами;
- отравлением;
- воздействием желудочного сока при рефлюкс-эзофагите;
- стрессом.
Симптомы бронхиальной астмы:
- кашель — развивается вследствие раздражения рецепторов бронхиол, имеет затяжной характер, усиливается от воздействия холодного воздуха и в ночное время — в период активации парасимпатической системы;
- бронхиальная экспираторная одышка — при астме затрудняется выдох, ограничивающий дыхание;
- хрипы со свистом, который слышен на расстоянии, — воздух проходит через суженные бронхиолы с обильной слизью;
- диффузный цианоз — вследствие окисления крови метгемоглобином во время приступа бронхиальной астмы кожа приобретает синюшный оттенок;
- дыхание с широко раскрытым ртом вследствие острой нехватки воздуха.
Диагностика бронхиальной астмы
Диагноз выставляется на основании клинических проявлений. Чтобы выявить бронхиальную астму в ранней стадии, проводятся функциональные пробы с применением бронходилататоров. Определяется степень обструкции дыхательных путей с помощью спирометрии. Для выявления аллергенов проводятся кожные скарификационные пробы.
Лабораторная диагностика бронхиальной астмы
Определить наличие предрасположенности к развитию атопической формы заболевания можно по генетическим анализам крови. Ведущую роль в развитии заболевания играет генный комплекс HLA на 6-й хромосоме, также имеет значение определение генетических маркеров антигенов системы HLA, сцепленных с генами, отвечающими за предрасположенность к бронхиальной астме. Кроме этого за предрасположенность к бронхиальной астме отвечают гены системы детоксикации, гены воспалительного ответа и антиоксидантной защиты.
В общем анализе крови определяется повышенное количество эозинофилов. В анализах мокроты — кристаллы Шарко-Лейдена, тельца Креола и спирали Куршмана при большом количестве эозинофилов.
Лечение
При бронхиальной астме применяются методы базисной и симптоматической терапии. Для снижения риска побочных аллергических реакций используется принцип рациональной комбинации фармакологических средств.

Препараты для базисной терапии:
- кромоны;
- глюкокортикостероиды, в том числе в ингаляционных формах;
- моноклональные антитела;
- антагонисты лейкотриеновых рецепторов.
Препараты для симптоматической терапии бронхиальной астмы:
- β2-адреномиметики короткого и длительного действия;
- ксантины;
- муколитики;
- антибиотики — применяются в случаях присоединившейся бактериальной инфекции.
Профилактика бронхиальной астмы
При положительных генетических анализах женщинам, находящимся в группе риска, рекомендуется проведение во время беременности иммунокоррекции. Чтобы предотвратить развитие бронхиальной астмы у детей, следует исключить контакт с потенциальными аллергенами.
Источник
Генетическая детерминированность бронхиальной астмы.Говоря о генетической детерминированности воспаления при бронхиальной астме, невозможно обойти вниманием сведения о мутации, затрагивающей ген, который кодирует адренергический рецептор (замена: глицин вместо аргинина в позиции 16). Данная мутация, как оказалось, лежит в основе тяжелой стероидозависимой астмы. Механизмы связи рассматриваемого генного дефекта с развитием глюкокор-тикоидной недостаточности (или кортизолрезистентности) в настоящее время неизвестны, однако роль указанных нарушений в формировании воспалительного процесса не вызывает сомнения. Молекулярно-генетические исследования, безусловно, углубляют наши представления о механизмах отдельных этапов развития воспаления. Уже на сегодняшний день имеющиеся на этот счет сведения подчеркивают выраженную гетерогенность базисных основ формирования воспалительного процесса, в том числе при атопических заболеваниях. Не случайно большинство авторов подчеркивает невозможность связать патогенез воспалительных изменений — даже при конкретной нозологической форме -с каким-то одним генным дефектом. Это, в определенной мере, подтверждает, на наш взгляд, обоснованность выдвигаемого отечественной школой клиницистов-пульмонологов принципа индивидуализации (дифференцированности) подходов к лечению, в частности, воспалительной патологии бронхов и легких. Резюмируя изложенное, хочется выразить надежду на то, что углубленное изучение молекулярно-генетических механизмов патогенеза воспалительных процессов предоставит возможность — пусть и не в очень близкой перспективе — разработки методов коррекции биологических дефектов, лежащих в их основе. Исследования этиологии воспалительных процессов на уровне установления генных дефектов пока только начинаются. Более доступным, особенно для клиницистов, представляется изучение маркеров предрасположения — физиологических признаков, частота встречаемости которых при той или иной патологии выше, чем в общей популяции.
Первоначально исследования в этой области касались конституциональных особенностей. Атопические болезни, в частности бронхиальная астма, рассматривались как аномалии конституции. Более достоверными маркерами, отражающими некоторые элементы патогенеза, являются иммунологические и биохимические системы: сюда относят эритроцитарные и лейкоцитарные аллоантигены, антигены белков плазмы, различные изоферменты. Результаты работ по изучению ассоциаций между группами крови и аллергическими заболеваниями неоднозначны. В ряде работ (Ксенофонтов Ю.П. 1980; Серова Л.Д., 1980) отмечено преобладание среди больных бронхиальной астмой лиц с группой крови 0(1), что объясняется способностью лиц этой группы крови к развитию сильного и сверхсильного иммунного ответа. Другие авторы, напротив, выявляли преобладание антигенов А (II) и В (Ш) и снижение числа лиц, принадлежащих к группе О (I) — [Filsoufi I., 1975]. Определенные особенности выявлены в отношении других антигенных эритроцитарных систем. Имеются указания на ассоциации эритроцитарных антигенов с отдельными иммунологическими параметрами у здоровых лиц [Гургенидзе Г.В., 1988]. При изучении белков крови и изоферментов найдено приеобладание фенотипа 2-1 гаптоглобина [Ксенофонтов Ю.П., 1980] и фенотипов А и АВ кислой фосфатазы эритроцитов (Brachtel R., 1979). Определенный интерес представляют данные по изучению распределения «секретеров» и «несекреторов» среди больных: показано преобладание «несекреторов» среди больных бронхиальной астмой [Deuberough М, 1968], что объясняют их неспособностью, в отличие от «секретеров», нейтрализовать антигены, содержащиеся в пыльце, пыли. Кроме того, полагают, что секреция АВН-антигенов предохраняет эпителий дыхательных путей от повреждения (Cohen В. et al., 1980). Существует мнение (Menkes Н., 1980), что неспособность секретировать антигены АВН является одним из важнейших факторов, предрасполагающих к воспалительной патологии бронхов и легких. Однако наиболее перспективным представляется изучение связи заболеваний с антигенами системы HLA. Антигены этой системы представляют собой сравнительно легко определяемые генетические маркеры, а полиморфизм системы отражает все многообразие возможных комбинаций, встречающихся в человеческой популяции. Главный комплекс гистосовместимости (система HLA) располагается на коротком плече 6-й хромосомы и в функциональном отношении представляет собой центральный генетический аппарат для функционирования иммунной системы человека и осуществления некоторых обменных процессов как в норме, так и при различных патологических состояниях. Чаще всего связь HLA и заболеваний проявляется в форме ассоциаций. Частичное объяснение имеющихся связей дает сама структура короткого плеча 6-й хромосомы, где находятся, помимо локусов HLA А, В, С, D, локусы 2-го и 4-го компонентов комплемента, В-фактора пропердина, возможно, Ir-Ds-генов. Гены HLA, ассоциированные с заболеваниями, можно рассматривать как гены восприимчивости к заболеваниям, либо как маркеры локусов, сцепленных с истинными генами, определяющими предрасположенность к заболеваниям. — Также рекомендуем «HLA-антигены и бронхиальная астма.» Оглавление темы «Гипероксалурическая патология легких.»: |
Источник


