Генетическими маркерами бронхиальной астмы

Название болезни в переводе с греческого языка означает «удушье». Бронхиальная астма — удушье по причине спазма бронхиол. Их воспаление происходит без инфекционного агента, поэтому невозможно заразиться бронхиальной астмой. Заболевание имеет хроническое течение, периоды ремиссии сменяются обострениями, которые часто носят сезонный характер.
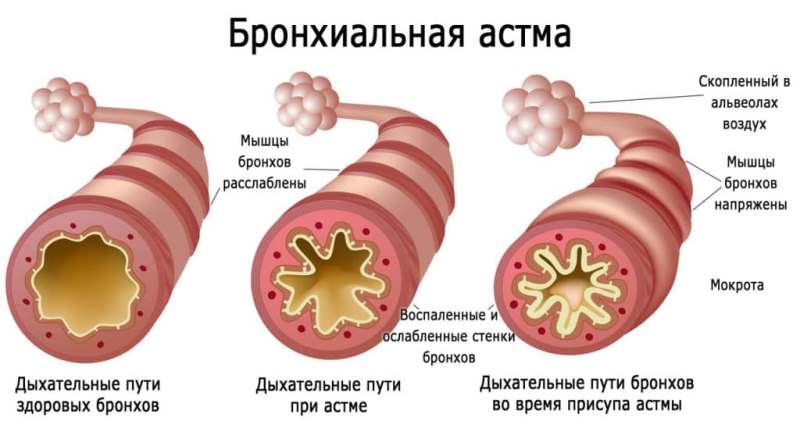
Причины развития бронхиальной астмы
Приступы удушья провоцируются воздействием аллергенов на рецепторы бронхиол. В большинстве случаев развитие бронхиальной астмы обусловлено мутацией гена, кодирующего адренергический рецептор. Происходит замена одного аминокислотного остатка — в позиции «16» аргинин замещает глицин. В результате усиливается реакция мелких бронхиол на влияние раздражителя — триггера, запускающего иммунную реакцию по гиперергическому типу.

Раздражение рецепторов приводит к активации иммунных клеток, выделяющих медиаторы воспаления, под действием которых происходит спазм мышечной оболочки бронхиол и усиливается секреция эпителиальных клеток. Во время приступа бронхиальной астмы создается парадоксальная ситуация: при полном заполнении легких ощущается острая нехватка кислорода.
Триггеры при бронхиальной астме:
- бытовые аллергены — пылевые клещи, шерсть домашних животных;
- сезонные природные факторы — пыльца растений, в том числе берез;
- продукты питания;
- косметика;
- лекарственные средства — ингибиторы ЦОГ1 и ЦОГ2 — нестероидные противовоспалительные препараты (аспириновая бронхиальная астма);
- производственная пыль и взвеси, в том числе лакокрасочных материалов.
Формы бронхиальной астмы:
- атопическая — аллергенная;
- неаллергическая — вызывается анатомическими изменениями бронхов вследствие первичного поражения слизистой оболочки бронхиального древа;
- смешанная.
Неаллергическая бронхиальная астма развивается на фоне длительно текущего бронхита как инфекционной, так и неинфекционной природы. Последнее провоцируется следующими вредными факторами:
- табачным дымом;
- ожогами;
- отравлением;
- воздействием желудочного сока при рефлюкс-эзофагите;
- стрессом.
Симптомы бронхиальной астмы:
- кашель — развивается вследствие раздражения рецепторов бронхиол, имеет затяжной характер, усиливается от воздействия холодного воздуха и в ночное время — в период активации парасимпатической системы;
- бронхиальная экспираторная одышка — при астме затрудняется выдох, ограничивающий дыхание;
- хрипы со свистом, который слышен на расстоянии, — воздух проходит через суженные бронхиолы с обильной слизью;
- диффузный цианоз — вследствие окисления крови метгемоглобином во время приступа бронхиальной астмы кожа приобретает синюшный оттенок;
- дыхание с широко раскрытым ртом вследствие острой нехватки воздуха.
Диагностика бронхиальной астмы
Диагноз выставляется на основании клинических проявлений. Чтобы выявить бронхиальную астму в ранней стадии, проводятся функциональные пробы с применением бронходилататоров. Определяется степень обструкции дыхательных путей с помощью спирометрии. Для выявления аллергенов проводятся кожные скарификационные пробы.
Лабораторная диагностика бронхиальной астмы
Определить наличие предрасположенности к развитию атопической формы заболевания можно по генетическим анализам крови. Ведущую роль в развитии заболевания играет генный комплекс HLA на 6-й хромосоме, также имеет значение определение генетических маркеров антигенов системы HLA, сцепленных с генами, отвечающими за предрасположенность к бронхиальной астме. Кроме этого за предрасположенность к бронхиальной астме отвечают гены системы детоксикации, гены воспалительного ответа и антиоксидантной защиты.
В общем анализе крови определяется повышенное количество эозинофилов. В анализах мокроты — кристаллы Шарко-Лейдена, тельца Креола и спирали Куршмана при большом количестве эозинофилов.
Лечение
При бронхиальной астме применяются методы базисной и симптоматической терапии. Для снижения риска побочных аллергических реакций используется принцип рациональной комбинации фармакологических средств.

Препараты для базисной терапии:
- кромоны;
- глюкокортикостероиды, в том числе в ингаляционных формах;
- моноклональные антитела;
- антагонисты лейкотриеновых рецепторов.
Препараты для симптоматической терапии бронхиальной астмы:
- β2-адреномиметики короткого и длительного действия;
- ксантины;
- муколитики;
- антибиотики — применяются в случаях присоединившейся бактериальной инфекции.
Профилактика бронхиальной астмы
При положительных генетических анализах женщинам, находящимся в группе риска, рекомендуется проведение во время беременности иммунокоррекции. Чтобы предотвратить развитие бронхиальной астмы у детей, следует исключить контакт с потенциальными аллергенами.
Источник
Генетическая детерминированность бронхиальной астмы.Говоря о генетической детерминированности воспаления при бронхиальной астме, невозможно обойти вниманием сведения о мутации, затрагивающей ген, который кодирует адренергический рецептор (замена: глицин вместо аргинина в позиции 16). Данная мутация, как оказалось, лежит в основе тяжелой стероидозависимой астмы. Механизмы связи рассматриваемого генного дефекта с развитием глюкокор-тикоидной недостаточности (или кортизолрезистентности) в настоящее время неизвестны, однако роль указанных нарушений в формировании воспалительного процесса не вызывает сомнения. Молекулярно-генетические исследования, безусловно, углубляют наши представления о механизмах отдельных этапов развития воспаления. Уже на сегодняшний день имеющиеся на этот счет сведения подчеркивают выраженную гетерогенность базисных основ формирования воспалительного процесса, в том числе при атопических заболеваниях. Не случайно большинство авторов подчеркивает невозможность связать патогенез воспалительных изменений — даже при конкретной нозологической форме -с каким-то одним генным дефектом. Это, в определенной мере, подтверждает, на наш взгляд, обоснованность выдвигаемого отечественной школой клиницистов-пульмонологов принципа индивидуализации (дифференцированности) подходов к лечению, в частности, воспалительной патологии бронхов и легких. Резюмируя изложенное, хочется выразить надежду на то, что углубленное изучение молекулярно-генетических механизмов патогенеза воспалительных процессов предоставит возможность — пусть и не в очень близкой перспективе — разработки методов коррекции биологических дефектов, лежащих в их основе. Исследования этиологии воспалительных процессов на уровне установления генных дефектов пока только начинаются. Более доступным, особенно для клиницистов, представляется изучение маркеров предрасположения — физиологических признаков, частота встречаемости которых при той или иной патологии выше, чем в общей популяции.
Первоначально исследования в этой области касались конституциональных особенностей. Атопические болезни, в частности бронхиальная астма, рассматривались как аномалии конституции. Более достоверными маркерами, отражающими некоторые элементы патогенеза, являются иммунологические и биохимические системы: сюда относят эритроцитарные и лейкоцитарные аллоантигены, антигены белков плазмы, различные изоферменты. Результаты работ по изучению ассоциаций между группами крови и аллергическими заболеваниями неоднозначны. В ряде работ (Ксенофонтов Ю.П. 1980; Серова Л.Д., 1980) отмечено преобладание среди больных бронхиальной астмой лиц с группой крови 0(1), что объясняется способностью лиц этой группы крови к развитию сильного и сверхсильного иммунного ответа. Другие авторы, напротив, выявляли преобладание антигенов А (II) и В (Ш) и снижение числа лиц, принадлежащих к группе О (I) — [Filsoufi I., 1975]. Определенные особенности выявлены в отношении других антигенных эритроцитарных систем. Имеются указания на ассоциации эритроцитарных антигенов с отдельными иммунологическими параметрами у здоровых лиц [Гургенидзе Г.В., 1988]. При изучении белков крови и изоферментов найдено приеобладание фенотипа 2-1 гаптоглобина [Ксенофонтов Ю.П., 1980] и фенотипов А и АВ кислой фосфатазы эритроцитов (Brachtel R., 1979). Определенный интерес представляют данные по изучению распределения «секретеров» и «несекреторов» среди больных: показано преобладание «несекреторов» среди больных бронхиальной астмой [Deuberough М, 1968], что объясняют их неспособностью, в отличие от «секретеров», нейтрализовать антигены, содержащиеся в пыльце, пыли. Кроме того, полагают, что секреция АВН-антигенов предохраняет эпителий дыхательных путей от повреждения (Cohen В. et al., 1980). Существует мнение (Menkes Н., 1980), что неспособность секретировать антигены АВН является одним из важнейших факторов, предрасполагающих к воспалительной патологии бронхов и легких. Однако наиболее перспективным представляется изучение связи заболеваний с антигенами системы HLA. Антигены этой системы представляют собой сравнительно легко определяемые генетические маркеры, а полиморфизм системы отражает все многообразие возможных комбинаций, встречающихся в человеческой популяции. Главный комплекс гистосовместимости (система HLA) располагается на коротком плече 6-й хромосомы и в функциональном отношении представляет собой центральный генетический аппарат для функционирования иммунной системы человека и осуществления некоторых обменных процессов как в норме, так и при различных патологических состояниях. Чаще всего связь HLA и заболеваний проявляется в форме ассоциаций. Частичное объяснение имеющихся связей дает сама структура короткого плеча 6-й хромосомы, где находятся, помимо локусов HLA А, В, С, D, локусы 2-го и 4-го компонентов комплемента, В-фактора пропердина, возможно, Ir-Ds-генов. Гены HLA, ассоциированные с заболеваниями, можно рассматривать как гены восприимчивости к заболеваниям, либо как маркеры локусов, сцепленных с истинными генами, определяющими предрасположенность к заболеваниям. — Также рекомендуем «HLA-антигены и бронхиальная астма.» Оглавление темы «Гипероксалурическая патология легких.»: |
Источник
1. Barnes K.C., Freidhoff L.R., Nickel R., Chiu Y.F., Juo S.H., Hizawa N., Naidu R.P., Ehrlich E., Duffy D.L., Schou C., Levett P.N., Marsh D.G., Beaty T.H. Dense mapping of chromosome 12q13.12-q23.3 and linkage to asthma and atopy. J. Allergy Clin. Immunol., 1999, Vol. 104, pp. 485-491.
2. Carroll M.C., Katzman P., Alicot E.M., Koller B.H., Geraghty D.E., Orr H.T., Strominger J.L., Spies T. Linkage map of the human major histocompatibility complex including the tumor necrosis factor genes. Natl. Acad. Sci. USA, 1987, Vol. 84, no. 23, pp. 8535-8539.
3. Chen T., Liang W., Gao L., Wang Y., Liu Y., Zhang L., Zhang L. Association of single nucleotide polymorphisms in interleukin 12 (IL-12A and -B) with asthma in a Chinese population. Hum. Immunol., 2011, Vol. 72, no. 7, pp. 603-606.
4. Chen X., Xiong L., Qin S., Ma W., Zhou Q. Effect of tumor necrosis factor-alpha antagonism in asthma: a meta-analysis of the published literature. J. Huazhong Univ. Sci. Technoloq. Med. Sci., 2011, Vol. 31, no. 1, pp. 137-141.
5. Eijkemans M., Mommers M., de Vries S.I., van Buuren S., Stafleu A., Bakker I., Thijs C. Asthmatic symptoms, physical activity, and overweight in young children: a cohort study. Pediatrics, 2008, Vol. 121, no. 3, pp. e666-672.
6. Freidin M.B., Kobyakova O.S., Ogorodova L.M., Puzyrev V.P. Association of polymorphisms in the human IL4 and IL5 genes with atopic bronchial asthma and severity of the disease. Comp. Func. Genomics, 2003, Vol. 4, no. 3, pp. 346-350.
7. Gao J., Shan G., Sun B., Thompson P.J., Gao X. Association between polymorphism of tumour necrosis factor α-308 gene promoter and asthma: a meta-analysis. Thorax, 2006, Vol. 61, pp. 466-471.
8. Hoffmann S.C., Stanley E.M., Darrin Cox E., Craighead N., DiMercurio B.S., Koziol D.E., Harlan D.M., Kirk A.D., Blair P.J. Association of cytokine polymorphic inheritance and in vitro cytokine production in anti-CD3/ CD28-stimulated peripheral blood lymphocytes. Transplantation, 2001, Vol. 72, pp. 1444-1450.
9. Liu Y., Zhuo A., Liu W., Xu S., Li S. The -33C/T polymorphism in the interleukin 4 gene is associated with asthma risk: a meta-analysis. J. Investig. Allergol. Clin. Immunol., 2014, Vol. 24, no. 2, pp. 114-121.
10. Malek T.R. The main function of IL-2 is to promote the development of T regulatory cells. J. Leukoc. Biol., 2003, Vol. 74, no. 6, pp. 961-965.
11. Matesanz F., Fedetz M., Leyva L., Delgado C., Fernández O., Alcina A. Effects of the multiple sclerosis associated -330 promoter polymorphism in IL2 allelic expression. J. Neuroimmunol., 2004, Vol. 148, no. 1-2, pp. 212-217.
12. Mörmann M., Rieth H., Hua T.D., Assohou C., Roupelieva M., Hu S.L., Kremsner P.G., Luty A.J., Kube D. Mosaics of gene variations in the Interleukin-10 gene promoter affect interleukin-10 production depending on the stimulation used. Genes Immun., 2004, Vol. 5, no. 4, pp. 246-255.
13. Movahedi M., Mahdaviani S.A., Rezaei N., Moradi B., Dorkhosh S., Amirzargar A.A. IL-10, TGF-beta, IL-2, IL-12, and IFN-gamma cytokine gene polymorphisms in asthma. J. Asthma, 2008, Vol. 45, no. 9, pp. 790-794.
14. Nicolae D., Cox N.J., Lester L.A., Schneider D., Tan Z., Billstrand C., Kuldanek S., Donfack J., Kogut P., Patel N.M., Goodenbour J., Howard T., Wolf R., Koppelman G.H., White S.R., Parry R., Postma D.S., Meyers D., Bleecker E.R., Hunt J.S., Solway J., Ober C. Fine mapping and positional candidate studies identify HLA-G as an asthma susceptibility gene on chromosome 6p21. Am. J. Hum. Genet., 2005, Vol. 76, no. 2, pp. 349-357.
15. Nie W., Zhu Z., Pan X., Xiu Q. The interleukin-4 -589C/T polymorphism and the risk of asthma: a metaanalysis including 7,345 cases and 7,819 controls. Gene, 2013, Vol. 10, no. 520 (1), pp. 22-29.
16. Padrón-Morales J., Sanz C., Dávila I., Muñoz-Bellido F., Lorente F., Isidoro-García M. Polymorphisms of the IL12B, IL1B, and TNFA genes and susceptibility to asthma. J. Investig. Allergol. Clin. Immunol., 2013, Vol. 23, no. 7, pp. 487-494.
17. Sharma S., Sharma A., Kumar S., Sharma S.K., Ghosh B. Association of TNF haplotypes with asthma, serum IgE levels, and correlation with serum TNF-(alpha) levels. Am. J. Respir. Cell Mol. Biol., 2006, Vol. 35, pp. 488-495.
18. Smolnikova M.V., Smirnova S.V., Freidin M.B., Tyutina O.S. Immunological parameters and gene polymorphisms (C-590T IL4, C-597A IL10) in severe bronchial asthma in children from the Krasnoyarsk region, West Siberia. J. Circumpolar. Health., 2013, Vol. 5, p. 72.
19. Tang L., Lin H.G., Chen B.F. Association of IL-4 promoter polymorphisms with asthma: a meta-analysis. Genet. Mol. Res., 2014, Vol. 28, no. 13 (1), pp. 1383-1394.
20. Tang S.P., Liu Y.L., Wang S.B., Weng S.F., Chen S., Zhang M.J., Dong L., Guo Y.H., Lin D.R., Hua Y.H., Wang D.Y. Trends in prevalence and risk factors of childhood asthma in Fuzhou, a city in Southeastern China. J. Asthma, 2015, Vol. 52, no. 1, pp. 10-15.
21. Virchow J.C. Jr., Walker C., Hafner D., Kortsik C., Werner P., Matthys H., Kroegel C. T cells and cytokines in bronchoalveolar lavage fluid after segmental allergen provocation in atopic asthma. Am. J. Respir. Crit. Care Med., 1995, Vol. 151, pp. 960-968.
22. Wang R.S., Jin H.X., Shang S.Q., Liu X.Y., Chen S.J., Jin Z.B. Associations of IL-2 and IL-4 Expression and Polymorphisms With the Risks of Mycoplasma pneumoniae Infection and Asthma in Children. Arch. Bronconeumol., 2015, Vol. 51, no. 11, pp. 571-578.
23. Yang H.J. Association between the interleukin-4 gene C-589T and C+33T polymorphisms and asthma risk: a meta-analysis. Arch. Med. Res., 2013, Vol. 44, no. 2, pp. 127-135.
24. Zhang J., Tian C., Xiao Y., He C., Bogati A., Huang J., Fan H. The -308 G/A polymorphism in TNF-α gene is associated with asthma risk: an update by meta-analysis. J. Clin. Immunol., 2011, Vol. 31, pp. 174-185.
25. Zhang S., Li Y., Liu Y. Interleukin-4 -589C/T Polymorphism is Associated with Increased Pediatric Asthma Risk: A Meta-Analysis. Inflammation, 2015, Vol. 38, no. 3, pp. 1207-1212.
Источник
Биологические маркеры бронхиальной астмы
Применительно к бронхиальной астме такими показателями являются морфологические и функциональные изменения эозинофила. Большое значение в последнее время придается уровню оксида азота (NO) в выдыхаемом воздухе в качестве биомаркера.
БИОЛОГИЧЕСКИЕ МАРКЕРЫ БРОНХИАЛЬНОЙ АСТМЫ
Распространенность бронхиальной астмы в популяции (более 5%).
Обратимая обструкция дыхательных путей. Эозинофильная инфильтрация.
Повышение уровня эозинофильной пероксидазы, катионного протеина, протеина гранул.
Высокий уровень IgE в сыворотке крови.
Повышенные уровни IL-2, IL-4, IL-5 в крови и лаважной жидкости бронхов.
Повышенная концентрация оксида азота (NO) в выдыхаемом воздухе.
процесса при бронхиальной астме. Этот показатель высокочувствителен для контроля за эффективностью базисной терапии.
Использованные источники: xn--80ahc0abogjs.com
Генетические маркеры бронхиальной астмы
Говоря о генетической детерминированности воспаления при бронхиальной астме, невозможно обойти вниманием сведения о мутации, затрагивающей ген, который кодирует адренергический рецептор (замена: глицин вместо аргинина в позиции 16). Данная мутация, как оказалось, лежит в основе тяжелой стероидозависимой астмы. Механизмы связи рассматриваемого генного дефекта с развитием глюкокор-тикоидной недостаточности (или кортизолрезистентности) в настоящее время неизвестны, однако роль указанных нарушений в формировании воспалительного процесса не вызывает сомнения.
Молекулярно-генетические исследования, безусловно, углубляют наши представления о механизмах отдельных этапов развития воспаления. Уже на сегодняшний день имеющиеся на этот счет сведения подчеркивают выраженную гетерогенность базисных основ формирования воспалительного процесса, в том числе при атопических заболеваниях. Не случайно большинство авторов подчеркивает невозможность связать патогенез воспалительных изменений — даже при конкретной нозологической форме -с каким-то одним генным дефектом. Это, в определенной мере, подтверждает, на наш взгляд, обоснованность выдвигаемого отечественной школой клиницистов-пульмонологов принципа индивидуализации (дифференцированности) подходов к лечению, в частности, воспалительной патологии бронхов и легких.
Резюмируя изложенное, хочется выразить надежду на то, что углубленное изучение молекулярно-генетических механизмов патогенеза воспалительных процессов предоставит возможность — пусть и не в очень близкой перспективе — разработки методов коррекции биологических дефектов, лежащих в их основе.
Исследования этиологии воспалительных процессов на уровне установления генных дефектов пока только начинаются. Более доступным, особенно для клиницистов, представляется изучение маркеров предрасположения — физиологических признаков, частота встречаемости которых при той или иной патологии выше, чем в общей популяции.
Первоначально исследования в этой области касались конституциональных особенностей. Атопические болезни, в частности бронхиальная астма, рассматривались как аномалии конституции. Более достоверными маркерами, отражающими некоторые элементы патогенеза, являются иммунологические и биохимические системы: сюда относят эритроцитарные и лейкоцитарные аллоантигены, антигены белков плазмы, различные изоферменты.
Результаты работ по изучению ассоциаций между группами крови и аллергическими заболеваниями неоднозначны. В ряде работ (Ксенофонтов Ю.П. 1980; Серова Л.Д., 1980) отмечено преобладание среди больных бронхиальной астмой лиц с группой крови 0(1), что объясняется способностью лиц этой группы крови к развитию сильного и сверхсильного иммунного ответа. Другие авторы, напротив, выявляли преобладание антигенов А (II) и В (Ш) и снижение числа лиц, принадлежащих к группе О (I) — [Filsoufi I., 1975]. Определенные особенности выявлены в отношении других антигенных эритроцитарных систем. Имеются указания на ассоциации эритроцитарных антигенов с отдельными иммунологическими параметрами у здоровых лиц [Гургенидзе Г.В., 1988].
При изучении белков крови и изоферментов найдено приеобладание фенотипа 2-1 гаптоглобина [Ксенофонтов Ю.П., 1980] и фенотипов А и АВ кислой фосфатазы эритроцитов (Brachtel R., 1979).
Определенный интерес представляют данные по изучению распределения «секретеров» и «несекреторов» среди больных: показано преобладание «несекреторов» среди больных бронхиальной астмой [Deuberough М, 1968], что объясняют их неспособностью, в отличие от «секретеров», нейтрализовать антигены, содержащиеся в пыльце, пыли. Кроме того, полагают, что секреция АВН-антигенов предохраняет эпителий дыхательных путей от повреждения (Cohen В. et al., 1980). Существует мнение (Menkes Н., 1980), что неспособность секретировать антигены АВН является одним из важнейших факторов, предрасполагающих к воспалительной патологии бронхов и легких.
Однако наиболее перспективным представляется изучение связи заболеваний с антигенами системы HLA. Антигены этой системы представляют собой сравнительно легко определяемые генетические маркеры, а полиморфизм системы отражает все многообразие возможных комбинаций, встречающихся в человеческой популяции.
Главный комплекс гистосовместимости (система HLA) располагается на коротком плече 6-й хромосомы и в функциональном отношении представляет собой центральный генетический аппарат для функционирования иммунной системы человека и осуществления некоторых обменных процессов как в норме, так и при различных патологических состояниях. Чаще всего связь HLA и заболеваний проявляется в форме ассоциаций. Частичное объяснение имеющихся связей дает сама структура короткого плеча 6-й хромосомы, где находятся, помимо локусов HLA А, В, С, D, локусы 2-го и 4-го компонентов комплемента, В-фактора пропердина, возможно, Ir-Ds-генов. Гены HLA, ассоциированные с заболеваниями, можно рассматривать как гены восприимчивости к заболеваниям, либо как маркеры локусов, сцепленных с истинными генами, определяющими предрасположенность к заболеваниям.
Использованные источники: meduniver.com
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МАРКЕРЫ РАЗЛИЧНЫХ ФЕНОТИПОВ ПРОФЕССИОНАЛЬНОЙ БРОНХИАЛЬНОЙ АСТМЫ
Транскрипт
1 Федеральное государственное бюджетное научное учреждение «Научно-исследовательский институт медицины труда» 1-й Международный Молодежный Форум «ПРОФЕССИЯ и ЗДОРОВЬЕ» г. Москва, 31 мая 3 июня 2016 года МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МАРКЕРЫ РАЗЛИЧНЫХ ФЕНОТИПОВ ПРОФЕССИОНАЛЬНОЙ БРОНХИАЛЬНОЙ АСТМЫ ПОМЫКАНОВА Ю.С.
2 РАСПРОСТРАНЕННОСТЬ БРОНХИАЛЬНОЙ АСТМЫ — Около 300 млн. человек в мире болеют БА — Почти 7 млн. человек имеют БА в России, из них 1 млн. больных с тяжелой формой заболевания — Ежегодно увеличивается в среднем на 7% — Частота симптомов текущей бронхиальной астмы у россиян в 1,5-6 раз выше, чем в европейских странах — В 48% случаев диагноз БА определяется впервые, а у 3 из 5 больных диагноз установлен на поздних стадиях развития болезни Распространенность профессиональной бронхиальной астмы — От 10 до 15% случаев бронхиальной астмы связаны с профессиональной деятельностью — В структуре профессиональной патологии профессиональная астма занимает от 12,5 до 15,7%
3 ОПРЕДЕЛЕНИЕ БРОНХИАЛЬНОЙ АСТМЫ GINA 2014 (ДОПОЛНЕНИЯ 2015 Г., 2016 Г.) БА гетерогенное заболевание, преимущественно связанное с хроническим воспалением в дыхательных путях, сопровождающееся респираторными симптомами, такими как свистящее дыхание (хрипы), одышка, ощущение сдавленности в грудной клетке и кашель. Данные симптомы меняются по интенсивности и во времени и сопровождаются вариабельными нарушениями бронхиальной проходимости Фенотипы бронхиальной астмы: Аллергическая БА Неаллергическая БА БА с поздним дебютом БА с фиксированной обструкцией дыхательных путей БА у больных с ожирением
4 ЦЕЛЬ РАБОТЫ Поиск информативных молекулярно-генетических маркеров различных фенотипов профессиональной бронхиальной астмы для оценки риска развития и прогноза клинического течения указанного заболевания
5 Программа исследования: Гены провоспалительных цитокинов Полиморфизм гена фактора некроза опухоли альфа (ФНО-α, TNF- α G-308А) определяет ответ иммунной системы на воспаление. Указанный в литературе «дикий тип» аллель А модифицирует генную экспрессию, повышая продукцию провоспалительного цитокина ФНО Полиморфизм указанного гена интерлейкина 17 А (Ил-17А, IL-17A G-197А) определяет особенности патогенеза данной формы бронхиальной астмы, т.е. сочетание атопии и хронического инфекционного процесса Гены противоспалительных цитокинов Ген IL-4 участвует в формировании иммунного ответа. Вариант 590T повышает уровень продукции интерлейкина 4, приводит к угнетению клеточного иммунитета и повышению уровня IgE Интерлейкин 10 (IL10 С-592А) подавляет синтез цитокинов Т- клетками, снижает активность макрофагов, уменьшает продукцию воспалительных цитокинов Полиморфный вариант гена IL10 G-1082A приводит к снижению синтеза цитокина, что ведет к снижению противовоспалительной активности
6 ПРОГРАММА ИССЛЕДОВАНИЯ: Гены ферментов биотрансформации ксенобиотиков Полиморфный вариант гена EPHX1 Т-337С приводит к аминокислотным заменам тирозина на гистидин в 113 положении (Tyr-113His), что изменяет свойства фермента и приводит к снижению его активности на 50% — «медленный» аллель и уменьшает его способность к гидроксилированию ксенобиотиков Гены системы «протеолиз-антипротеолиз» Варианта гена матриксной металлопротеиназы 12 (ММП-12 А-82G), отвечающей за повышение экспрессии гена ММП 12, играет значимую роль в ремоделировании тканей, в репаративных процессах и воспалении. Фермент разрушает растворимый и нерастворимый эластин Гены системы антиоксидантной защиты Супероксиддисмутаза марганец зависимая (СОД 2, SOD2 Mn, митхондриальная) относится к группе антиоксидантных ферментов и контролирует уровень свободных радикалов в клетке. Вариант T-58C обуславливает снижение уровня MnSOD 2, обладающей протективными свойствами.
7 ХАРАКТЕРИСТИКА ОБСЛЕДОВАННЫХ ЛИЦ С ПБА ПО ПОЛУ, ВОЗРАСТУ, ПРОФЕССИОНАЛЬНЫМ ГРУППАМ Характеристика пациентов с ПБА по полу 58 Женщины Мужчины Характеристика пациентов с ПБА по профессиональным группам Строительные работы 4,1 1 2,3 112 Характеристика пациентов с ПБА по возрасту 8,2 5,3 6 4,7 1,2 2,4 1,2 1,2 41 Металлургическая промышленность % Медицинские и фармакологические предприятия Пекарно-кондитерское производство Сельско-хозяйственные работы 25,7 11, лет лет лет лет более 70 лет 30,5 Прядильныме комбинаты Ремонт, реставрация и переплет книг Обувные 54,7 менее 30 лет Обойные фабрики
8 ХАРАКТЕРИСТИКА ОБСЛЕДОВАННЫХ ГРУПП: Все обследованные лица в зависимости от формы профессиональной бронхиальной астмы были разделены на 4 основные группы: 1-я группа (68 человек) включала в себя больных ПБА, ассоциированной с инфекцией 2-я группа (57 человек) с аллергической ПБА 3-я группа (42 человека) представлена пациентами с сочетанной формой ПБА 4-ю группу, взятую в качестве контрольной, составили 40 человек, не имеющих диагноз профессиональная бронхиальная астма и контакта с производственными аллергенами
9 РЕЗУЛЬТАТЫ МОЛЕКУЛЯРНО- ГЕНЕТИЧЕСКИХ ИССЛЕДОВАНИЙ Полиморфные варианты генов цитокинов обследованных пациентов в сравнении с популяцией Полиморфные варианты генов системы «протеолиз-антипротеолиз», оксидантыантиоксиданты» и биотрансформации ксенобиотиков обследованных пациентов в сравнении с популяцией Таким образом, обнаружение полиморфных вариантов генов TNF- α G-308А, IL17A G-197A, IL4 С-589Т, IL10 G- 1082A, IL10 С-592А, EPHX1 Tyr-113His, MnSOD T-58C, ММР12 А-82G может свидетельствовать о нарушении соотношения уровня про- и противовоспалительных цитокинов, уменьшении способности к гидроксилированию ксенобиотиков, снижении уровня фермента антиоксидантной защиты, нарушении в системе «протеолиз-антипротеолиз, в следствии чего происходит активация воспалительных реакций у больных ПБА
10 АНАЛИЗ СВЯЗИ МЕЖДУ ИЗУЧЕННЫМИ ГЕНЕТИКО- БИОХИМИЧЕСКИМИ СИСТЕМАМИ И КЛИНИКО- ЛАБОРАТОРНЫМИ, БИОХИМИЧЕСКИМИ ПОКАЗАТЕЛЯМИ Частота повышения уровня СРБ в зависимости от генотипа ФНО-α Частота повышения уровня IgG в зависимости от генотипа интерлейкина-4 Доля лиц с ранним (до 5 лет) развитием ПБА в зависимости от генотипа EPHX1 (r=0,39; р 0,002) Частота повышения уровня СРБ в зависимости от генотипа Ил 17 А (r=0,37; р 0,04) Частота повышения уровня IgE в зависимости от генотипа интерлейкина-4 (r=0,29; р 0,04) (r=0,42; р 0,04)
11 ФАКТОРНЫЙ АНАЛИЗ Молекулярно-генетическиепоказатели Интерлейкин-17А (IL17A G-197A), интерлейкин-4 (IL4 С-589Т), интерлейкин-10 (IL- 10 C-592A), микросомальная эпоксидгидролаза 1 (EPHX1 Tyr-113His), супероксид дисмутаза (MnSOD, SOD2 T-58C) Факторные нагрузки показателей в 3х выделенных факторах (главных компонентах) Показатель Фактор 1 Фактор 2 Фактор 3 IL17 А -0, ,617271* -0, IL4 0,661519* 0, , IL10G -0, , , IL10C 0, ,621257* -0, ММР12 0, , ,556875* EPHX1 0, , ,571784* MnSOD 0, , ,527899* ФНО 0, , , По результатам анализа факторных нагрузок были выбраны показатели с наибольшими нагрузками, равными более 0,5 (независимо от знака; корреляции средней силы и сильные)
12 РЕЗУЛЬТАТЫ КЛАСТЕРНОГО АНАЛИЗА Карта кластеров при разбиении выборки на 6 кластеров Поиск показателейпредикторов фенотипа и определение чувствительности и специфичности предикторов Кумулятивный % дисперсии для 2х главных компонент = 49,4%. Увеличение значения показателя MMP-12 А-82G в сторону мутантной гетерозиготы (AG) и далее (GG) увеличивает вероятность фенотипа 4, уменьшение значения показателя MMP-12 в сторону нормы (AA) уменьшает вероятность фенотипа 4
13 Фенотип 1 ПБА Тяжесть течение 0-1 Возраст лет Хронические инф.заболевания дых.путей Иммуноглобулины класса А α-1-кг Неорганический фактор Согласующиеся симптомы Отсутствие особенностей в полиморфных вариантах генов Фенотип 3 ПБА Раннее развитие заболевания от начала работы до 5 лет Эозинофильное воспаление ОФВ1 25 лет. ОФВ1 11 лет. Строительные работы. Спаечные процессы и пневмосклероз. α-1-кг, СРБ, гаптоглобин. Эндокринная патология. Ангиосклероз
15 ВЫВОДЫ 1. У больных профессиональной бронхиальной астмой выявлено достоверное превышение частоты встречаемости по сравнению с популяцией полиморфных генов про- и противовоспалительных цитокинов (TNF- α G-308А, IL17A G- 197A, IL4 С-589Т, IL10 G-1082A, IL10 С-592А), генов системы «протеолиз-антипротеолиз» (ММР-12 А-82G), генов системы антиоксидантной защиты (MnSOD T-58C), генов системы биотрансформации ксенобиотиков (EPHX1 Tyr-113His), что свидетельствует об участии изученных систем в патогенезе данной нозологической формы и возможности использования указанных показателей в качестве информативных молекулярных критериев при формировании различных фенотипов ПБА. 2. Выявлена достоверная корреляция между тяжестью клинического течения, изменением биохимических и иммунологических показателей в сочетании с неблагоприятными аллелями полиморфных генов изученных биохимических систем.
Использованные источники: docplayer.ru
Открытая медицинская библиотека
Статьи и лекции по медицине ✚ Библиотека студента-медика ✚ Болезни и способы их лечения.
Категории
Заболевания ГЕНЕТИКА БРОНХИАЛЬНОЙ АСТМЫ
Во многих исследованиях показано увеличение распространенности БА среди кровных родственников больных, страдающих этим заболеванием (20 — 25% по сравнению с 4% в общей популяции) [135], что предполагает участие в его развитии генетических факторов. Считается, что их вклад в формирование болезни составляет 35 — 70% [136, 137].
В современной генетике в течение последних десятилетий достигнуты большие успехи в понимании структуры и функции человеческого генома. Значительный прогресс наблюдался и в определении роли генетических факторов в развитии фенотипов астмы. Установлено, что отсутствует конкретный и единственный «ген астмы». Вероятно, эта болезнь возникает в результате взаимодействия генов между собой и с окружающей средой [138, 139]. Вместе с тем остается неясным, какое количество генов способствует развитию БА в различных этнических группах.
Поиск генов, связанных с формированием астмы, осуществлялся в 4 направлениях: выработка аллергенспецифических IgE (атопия), развитие бронхиальной гиперреактивности, синтез медиаторов воспаления (цитокинов, хемокинов, факторов роста), соотношение между типами иммунного ответа с участием Th1- и Th2-лимфоцитов.
Изучение семей и анализ взаимосвязи в исследованиях «случай — контроль» показали, что фенотипы астмы могут определяться рядом локусов хромосом [140 — 143]. Идентифицировано более 100 генов, связанных с БА [144, 145]. Основные группы генов приведены в табл. 8-27.
Таблица 8-27. Основные группы генов, связанных с астмой
Вместе с тем имеются расхождения между результатами проведенных исследований. Οʜᴎ бывают частично объяснены анализом различных фенотипов астмы, этническими различиями обследованных популяций и наличием ложноположительных взаимосвязей. Несмотря на это, были неоднократно выявлены несколько областей генома, касающихся развития БА: хромосомная область 5q31 — 33 [146, 147], 11q [148] и 12q [149, 150]. При этом следует отметить, что пока не существует крайне важного числа исследований, которые бы повторяли эти результаты.
Использованные источники: medic.oplib.ru
Биологические маркеры бронхиальной астмы
Применительно к бронхиальной астме такими показателями являются морфологические и функциональные изменения эозинофила. Большое значение в последнее время придается уровню оксида азота (NO) в выдыхаемом воздухе в качестве биомаркера.
БИОЛОГИЧЕСКИЕ МАРКЕРЫ БРОНХИАЛЬНОЙ АСТМЫ
Распространенность бронхиальной астмы в популяции (более 5%).
Обратимая обструкция дыхательных путей. Эозинофильная инфильтрация.
Повышение уровня эозинофильной пероксидазы, катионного протеина, протеина гранул.
Высокий уровень IgE в сыворотке крови.
Повышенные уровни IL-2, IL-4, IL-5 в крови и лаважной жидкости бронхов.
Повышенная концентрация оксида азота (NO) в выдыхаемом воздухе.
процесса при бронхиальной астме. Этот показатель высокочувствителен для контроля за эффективностью базисной терапии.
Использованные источники: xn--80ahc0abogjs.com
загрузка…
Источник