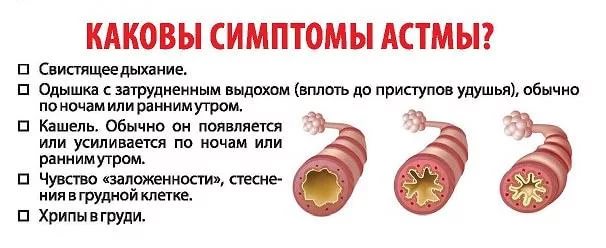
Изучение генов при астме
Обсуждается генетический компонент развития бронхиальной астмы. Гены-кандидаты расположены на хромосомах 2, 4, 7, на кластере цитокинов, на хромосоме 5 и на хромосоме 6 в области MHC.
Genetics of bronchial asthma
Authors discussed genetic component development of bronchial asthma. Candidate genes located on chromosomes 2, 4, 7, on a cluster of cytokines, on chromosome 5 and on chromosome 6 in the MHC.
Бронхиальная астма (БА) — заболевание с выраженной наследственной предрасположенностью. Дети, имеющие родственников первой линии родства с БА, имеют высокий риск развития клинических проявлений астмы [1]. Некоторые клиницисты большое внимание уделяют признакам мезенхимальной дисплазии как внешним маркерам генетических особенностей. У пациентов с БА часто встречаются множественные стигмы дисморфогенеза, патология соединительной ткани, кожные факомы. По итогам близнецовых исследований, генетический вклад в развитие БА оценивается в 30-70%.
Таблица 1.
Риск атопии у пробанда при достижении им возраста 7 лет в зависимости от наличия атопии в семейном анамнезе
| Семейный анамнез | Риск развития атопии (%) |
| Нет атопии | 10 |
| Один из родителей страдает атопией | 20 |
| Сиблинги страдают атопией | 35 |
| Оба родителя страдают атопией, но разными вариантами | 42 |
| Оба родителя страдают атопией, клиническая форма идентична | 75 |
БА — типичное заболевание мультифакториальной природы, развитие которого определяется взаимодействием наследственных факторов (мутаций или сочетаний аллелей) и факторов среды.
В последние годы генетические исследования при астме ведутся по нескольким направлениям: выявление вариантов генов, которые могут предсказать ответ на терапию, выявление вариантов генов, которые связаны с развитием болезни и играющих решающую роль в патофизиологии заболевания.
Верифицированы несколько групп генов-кандидатов, которые важны в развитии БА.
Гены атопии или гуморального иммунного ответа локализованы в участках хромосомы 5q24-33 и содержат кластер семейства генов цитокинов (IL-4, IL-5, IL-13, IL-3, GM-CSF), ответственный за развитие реакций немедленного типа (IgE-опосредованных реакций). IL-4, IL-13 экспрессируются Th-2 лимфоцитами и способствуют переключению В-клеток на синтез IgE. IL-5 и GM-CSF — цитокины, обеспечивающие созревание, выживание и хемотаксис эозинофилов. К этой группе также относят HLA-DR (гены молекул II класса МНС) — важные молекулы, участвующие в презентации антигена. Имеющиеся сегодня данные свидетельствуют, что полиморфизм генов интерлейкинов и их рецепторов является важным генетическим фактором возникновения БА и атопии [2, 3].
Гены рецепторных молекул (IL-4Rα, FcεRI β, ADRβ2). IL-4Rα — альфа цепь рецептора IL-4. Mitsuyasu et al. [4] сообщили о полиморфном варианте гена Ile50Val IL-4Rα цепи, наличие которого повышает синтез IgE и является одним из определяющих наследственных факторов возникновения атопической формы заболевания. В 17% случаев замена одного аминокислотного остатка (изолейцина лейцином в позиции 181) в гене, кодирующем β-субъединицу высокоаффинного рецептора к IgE (FcεRI β), приводит к развитию бронхиальной астмы. Однако аналогичные исследования, проведенные в Италии и Японии, такой закономерности не выявили.
Продукт ADRβ2 (гена β2-адренергического рецептора; 11q13) контролирует лабильность бронхов. Установлен полиморфизм гена ADRβ2 (Arg16Gly и Glu27Gln), определяющий повышенную вероятность развития тяжелой бронхиальной астмы. Более того, больные гомозиготные по этим вариантам гена быстро теряют чувствительность к β2-агонистам и требуют лечения гормональными препаратами [5]. Это является одним из достижений в фармакогенетике БА. Причем ген рецептора IL-4 (IL4RA) и ген, кодирующий β-субъединицу высокоаффинного рецептора к IgE (FcεRI β), могут быть отнесены к генам атопии, а ген ADRβ2 — к генам бронхиальной гиперреактивности.
Южнокорейскими учеными [6] выявлены 2 полиморфных гена CRTH2, экспрессирующихся на поверхности эозинофилов, с однонуклеотидными заменами -466T>C и -129C>A, которые тесно связаны с инфильтрацией эозинофилами дыхательных путей у больных с аспирин-индуцированной БА. Гены факторов транскрипции — STAT6, JAK1, JAK3 [7] ассоциированы с наличием БА. Последний мета-анализ объединил результаты 11 исследований [8]. Выявлены хромосомные регионы, содержащие ведущие гены восприимчивости к БА, при использовании самых строгих статистических критериев. К ним относятся 6p22.3-p21.1 (гиперактивность бронхов), 5q11.2-q14.3 и 6pter-p22.3 (концентрация общего IgE), 3p22.1-q22.1, и 17p12-q24.3 (положительный кожный тест). Однако никакой преобладающей ассоциации среди указанных регионов не обнаружено, что объясняет гетерогенность болезни и вариабельность диагноза в разных популяциях разных стран.
Признано, что многочисленные гены взаимодействуют между собой при БА и атопии, повышая или уменьшая риск развития болезни. При наличии генов, кодирующих IL-13 и IL-4RA (обе ключевые молекулы в Th-2 сигнализации), выявлен в 2,5 раза больший риск развития БА, чем у индивидуумов с наличием одного гена. Исследование четырех генов показало, что комбинация определенного однонуклеотидного полиморфизма (SNPs) в IL-13, IL-4, IL4RА, и STAT 6 сопровождается 16,8-кратным увеличением риска БА. Эти сведения указывают на значение изучения взаимодействия генов при сложных болезнях и объясняют их роль в развитии и прогрессировании болезни.
Имеется предположение, что эндогенная БА — аутоиммунное заболевание, опосредованное аутоантителами к эпителиальному антигену. Не исключено, что появление аутоантител связано с генетически обусловленным дефицитом антиоксидантной системы. Свободные радикалы способны превращать макромолекулы в аутоантигены. На их возникновение иммунная система отвечает выработкой специфических аутоантител. В организме запускается аутоиммунный процесс, который в конечном итоге и приводит к БА. В этой связи относительно недавно обнаружена субпопуляция T-хелперов, названная Th17 [9], играющая значимую роль при аутоиммунных заболеваниях.
IL-17 является эффекторным цитокином, который продуцируют Th17 клетки, и его повышенная концентрация выявлена в слюне больных БА [10]. Однако имеются исследования [11] о варианте гена IL-17, His161Arg, который ассоциирован с протективным эффектом при астме. В 2009 году обнаружены новые гены восприимчивости к БА, не связанные с иммунной системой. Полиморфизм генов хитиназы и хитиназоподобных белков CHIT1, CHIA, CHI3L1 сочетается с риском БА.
Относительно недавно был охарактеризован первый позиционно клонированный ген астмы ADAM33 [12] на хромосоме 20p13. Анализ 135 однонуклеотидных полиморфизмов в 23 из них показал наиболее существенную ассоциацию заболевания с вариантом гена ADAM33, который кодирует металлопротеазу, играющую важную роль в функционировании гладких мышц бронхов и фибробластов легкого. Эти данные свидетельствуют о важной роли ADAM33 в ремоделировании дыхательных путей. В настоящее время роль этих генетических вариаций, связанных с восприимчивостью к астме, подтверждена в Саудовской Аравии, Китае [13]. В локусе хромосомы 1q31 в 2010 году был идентифицирован ген DENND1B, который экспрессируется натуральными киллерами и дендритными клетками, кодирует белок, взаимодействующий с рецептором фактора некроза опухоли, и связан с развитием БА [14].
Гены-модификаторы (GSTM1, GSTT1, CYP2E1, NAT2, SLC11A1). На сегодняшний день известно, что в патологии БА принимают участия белковые продукты генов системы детоксикации ксенобиотиков. Недавними исследованиями Сардарян И.С. [15] изучены фенотипические особенности БА при аллельном полиморфизме генов глутатион-S-трансферазы Т1 (GSTT1), глутатион-S-трансферазы М1 (GSTM1), ангиотензин превращающего фермента (ACE), эндотелиальной синтазы оксида азота (eNOS). Выявлено, что ассоциация генотипов GSTT1-GSTM1‑ повышает в 5 раз риск развития БА у детей по сравнению с популяцией. У детей при функционально активном генотипе GSTT1+GSTM1+ в ассоциации с полиморфизмом II по гену АСЕ риск развития БА снижается в 7 раз, что позволяет считать данную ассоциацию генотипов протективной.
В заключение можно указать, что к развитию астмы причастны много генов, расположенных на разных хромосомах. Прежде всего это генный комплекс HLA на 6-й хромосоме. Кроме того, с развитием БА связаны:
- локусы 2 pter*
- 2q6 (реакция на домашних клещей)
- 2q33 (CD28; белок, связывающий инсулиноподобный фактор)
- 3p24.2-p22 (С-С рецептор хемокина)*
- 4q35 (интерферонорегулирующий фактор-2)*
- 5q15 (ген не идентифицирован)
- 5q23-q33 (IL-3; IL-4; IL-5; IL-9; IL-13; глюкокортикоидный рецептор)**
- 5q31 (гены регуляции IgE). В непосредственной близости расположены гены бронхиальной гиперреактивности и адренергических b2 рецепторов
- 6p21.1-p23 (HLA, фактор некроза опухолей α)*
- 7р15.2 (Т-клеточный рецептор G, IL-6)*
- 9q31.1 (тропомиозин связывающий белок)*
- 11р15 (ген не идентифицирован)
- 11q13 (ген b-цепи высоко аффинного IgE рецептора, триггер аллергических реакций на мастоцитах, передается по материнской линии, отцовский «импринтинг» вероятен)**
- 12q (синтаза оксида азота)
- 12q14-q24.33 (сигнальный кондуктор и активатор транскрипции 6; интерферон γ; фактор стволовых клеток; инсулин-подобный фактор роста 1; лейкотриен А4 гидролаза; β субъединица ядерного фактора Y; В-клеточный транслокационный ген 1)**
- 13q14.3-qtep (трансляционно контролируемый протеин-1 опухоли)*
- 16q22.1-q24.2 (ген не идентифицирован)
- 17p11.1-q11.2 (хемокиновый кластер)
- 19q13 (CD22)
- 21q21 (ген не идентифицирован)
- Xq28/Yq28 (рецептор IL-9)
—————————————————
Примечание:
* — общие гены с атопией; ** — общие гены с атопией и атопическим дерматитом
Данный перечень генов, ответственных за развитие БА, не полон. Не упомянуты гены, участвующие в ремоделировании дыхательных путей, гетерогенна и гиперреактивность дыхательных путей. Все это делает понятным клинический полиморфизм заболевания.
Будет ли возможно в будущем предсказать развитие БА, базируясь на генетическом тестировании? Предсказующая величина тестирования единственного гена при полигенном наследовании болезни очень ограничена как для диагностики, так и в профилактических целях. В будущем прогноз астмы, возможно, будет основываться на оценке комплекса генов, персональных факторов и факторов риска окружающей среды, вместе содействующих развитию, персистенции, прогрессированию или ремиссии БА [16, 17].
Ю.И. Будчанов, В.М. Делягин
Тверская государственная медицинская академия
Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии, г. Москва
Будчанов Юрий Иванович — кандидат медицинских наук, доцент кафедры клинической иммунологии с аллергологией Тверской государственной медицинской академии.
Литература:
1. Burr M., Merrett T., Dunstan F., Maguire M. The development of allergy in high-risk children // Clinical and Experimental Allergy, 1997. — v. 27. — Р. 1247-1252.
2. Фрейдин М.Б., Огородова Л.М., Пузырев В.П. Вклад полиморфизма генов интерлейкинов в изменчивость количественных факторов риска атопической бронхиальной астмы // Мед. генетика, 2003. — Т. 2. — № 3. — С. 130-135.
3. Фрейдин М.Б., Брагина Е.Ю., Огородова Л.М., Пузырев В.П. Генетика атопии: современное состояние. // Вестник ВОГиС, 2006. — Том 10. — № 3 — С. 492-503.
4. Mitsuyasu H., Izuhara K., Mao X.-Q. et al. Ile50Val variants or IL4Ra upregulates IgE synthesis and associates with atopic asthma // Nat. genet., 1998. — v. 19. — Р. 119-120.
5. Wechsler M., Lehman E., Lazarus S. et al. National Heart, Lung and Blood Institute’s Asthma Clinical Research Network. beta-Adrenergic receptor polymorphisms and response to salmeterol //American Journal Respir. Crit. Care Medicine, 2006. — v. 173. — P. 519-526.
6. Palikhe N., Kim S-H., Cho B-Y. et al. Genetic variability in CRTH2 polymorphism increases eotaxin-2 levels in patients with aspirin exacerbated respiratory disease // Allergy, 2010. — v. 65. — Р. 338-346.
7. Moller M., Gravenor M., Roberts S. et al. Genetic haplotypes of Th-2 immune signalling link allergy to enhanced protection to parasitic worms. // Human Molecular Genetics, 2007. — v. 16. — Р. 1828-1836.
8. Denham S., Koppelman G, Blakey J. et al. Meta-analysis of genome-wide linkage studies of asthma and related traits // Respir. Research, 2008. — v. 9. — р. 38.
9. Weaver C., Hatton R., Mangan P., Harrington L. IL-17 family cytokines and the expanding diversity of effector T cell lineages // Annual Revy Immunology, 2007. — 25. — Р. 821-852.
10. Bullens D., Truyen E., Coteur L. et al. IL-17 mRNA in sputum of asthmatic patients: linking T cell driven inflammation and ranulocytic influx? // Respir. Res., 2006. — v. 7. — Р. 135.
11. Kawaguchi M., Takahashi D., Hizawa N. et al. IL-17F sequence variant (His161Arg) is associated with protection against asthma and antagonizes wild-type IL-17F activity // Journal of Allergy and Clinical Immunology, 2006. — v. 117. — Р. 795-801.
12. Van Eerdewegh P., Little R., Dupuis J. et al. Association of the ADAM33 gene with asthma and bronchial hyperresponsiveness // Nature, 2002. — v. 418. — Р. 426-430.
13. Bazzi M., Al-Anazi M., Al-Tassan N.A. et al. Genetic variations of ADAM33 in normal versus asthmatic Saudi patients // https://biotechcentersa.org/asthma-genetics/.
14. Sleiman P., Flory J., Imielinski M. et al. Variants of DENND1B associated with asthma in children // New England Journal of Medicine, 2010. — v. 362. — Р. 36-44.
15. Сардарян И.С. Фенотипические особенности бронхиальной астмы у детей при различных аллельных полиморфизмах генов «предрасположенности» (GSTТ1, GSTМ1, ACE, eNOS) / Автореф. дисс. к.м.н. — СПб, 2009. — 22 с.
16. Koppelman G., te Meerman G., Postma D. Genetic testing for asthma // Eur. Respir. J., 2008. — v. 32. — Р. 775-782.
17. Postma D., Koppelman G. Genetics of asthma: where are we and where do we go? // The Proceedings of the American Thoracic Society, 2009. — v. 6. — Р. 283-287.
Источник
Russel Hopp, MD
Академия иммунологии США
В последнее время все чаще появляются
публикации, посвященные генетическим
исследованиям астмы. Это позволяет предположить,
что в ближайшие несколько лет ген или гены,
ответственные за развитие этого заболевания,
будут обнаружены. Несмотря на то, что астма
является весьма распространенным заболеванием,
генетического объяснения ее развития не
существует. Более ранние клинические
исследования астмы и аллергии у близнецов
однозначно указывали на наличие генетических
причин обоих заболеваний. Современные методы
генетических исследований позволяют точно
определить, является ли заболевание генетически
обусловленным. Однако при попытке выяснить роль
генов в развитии астмы ученые столкнулись с
большими трудностями.
Проявления астмы в фенотипе
Астму довольно часто относят к разряду
синдромов, а не одиночных заболеваний. У этой
теории есть целый ряд клинических подтверждений.
У грудных младенцев и детей младшего возраста
часто отмечается стерторозное дыхание. Однако
такое дыхание может сопровождать множество
заболеваний, поэтому в этой возрастной группе
генетические исследования практически не
проводятся. Генетический анализ применяют при
обследовании больных астмой детей старше 6 лет.
Одним из важнейших факторов развития астмы у
детей является атопия (наследственная
предрасположенность к аллергическим
заболевания). Поэтому основная задача
генетических исследований — выяснить, является
ли заболевание астмой или атопическим
состоянием.
У взрослых наблюдается другое клиническое
проявление астмы, когда нет очевидных
аллергических «активаторов» заболевания. До сих
пор наследственную бронхиальную астму не
изучали отдельно.
Астма может иметь различные клинические
проявления. С помощью генетических исследований
можно определить, каким именно типом астмы
страдает конкретный пациент.
Поиск генов
Чаще всего участниками генетических
исследований астмы становятся братья и сестры
(особенно близнецы) и большие семьи. В этих
исследованиях для определения заболевания
используют следующие признаки астматических
состояний.
| Атопия | Астма |
| Повышенный уровень иммуноглобулина Е в сыворотке крови | Положительная реакция на провокационную пробу на метахолин |
| Положительные кожные пробы на стандартные аллергены | Положительная гистаминная проба |
| Положительная реакция на радиоаллергосорбентный тест | Kлиническая диагностика астмы |
| Восстановление бета-агониста | |
| Kомбинация симптомов из обеих колонок |
При генетических исследованиях тесты,
упомянутые в таблице, помогают однозначно
отнести пациента к разряду астматиков. Поиск
«генов астмы» ведется на основании имеющейся
биологической информации об этом заболевании.
При таком методе генетический анализ направлен
на определение статистической зависимости между
астмой и наличием определенного гена или
специфических хромосом. Результаты исследований
позволяют связать с аллергией такие гены, как IL-4,
IL-5, рецептор иммуноглобулина Е и
бета-адренергический рецептор. Если имеется
статистически существенная связь между наличием
астмы и наличием известного маркера на
специфической хромосоме, то можно предположить,
что ген астмы находится в этой хромосоме, в
области данной повторяющейся
последовательности оснований. В сущности, такой
генетический анализ — это процесс определения
«города, района, улицы и точного адреса». К
настоящему времени ученым удалось обнаружить
несколько «городов» (хромосом) и «районов»
(последовательностей генов).
На сегодняшний день основное внимание
привлекают хромосомы 5 и 11. В хромосоме 5
сосредоточены гены IL-4, IL-5, IL-3 и IL-13, которые имеют
отношение к аллергии. Исследования показывают,
что эта область генов отвечает за
сверхчувствительность бронхов к гистамину.
Кроме того, хромосома 5 (а именно, область генов IL-4
и IL-13) отвечает за концентрацию иммуноглобулина Е
в сыворотке крови. А в хромосоме 11 был обнаружен
важный ген атопии (рецептор иммуноглобулина Е).
К сожалению, у представителей разных рас
результаты генетических исследований астмы
оказались разными, что затрудняет однозначное
выявление гена астмы.
Геномные исследования
Геномный подход позволяет идентифицировать
гены, которые до сих пор не вызывали подозрений.
Используя целый геном, специалисты ищут
специфические сигнальные зоны, внутри которых
ведется дальнейший поиск генов. Так, у
афро-американцев многообещающими оказались
некоторые зоны хромосом 5 и 17. В других
исследованиях была обнаружена связь между
отдельными клиническими параметрами астмы и
атопии и хромосомами 2, 21, 11, 19, 7 и 16. Не исключено,
что искомый ген находится в одной из них.
Структурные вариации генов
Если будет обнаружен «ген астмы», то для
окончательного выяснения этиологии астмы нужно
будет исследовать все формы этого гена. Основной
вопрос заключается в том, определяют ли
структурные различия само наличие болезни, ее
форму или степень тяжести.
Заключение
Астма уже давно считается генетическим
заболеванием, возможно, полигенного
происхождения. Современные генетические
исследования полностью подтверждают эти
взгляды, и, вполне вероятно, скоро специалистам
удастся окончательно установить генетические
истоки астмы.
Перевод с английского Натальи
Байч
© Провизор 1998–2017
Источник
Обсуждается генетический компонент развития бронхиальной астмы. Гены-кандидаты расположены на хромосомах 2, 4, 7, на кластере цитокинов, на хромосоме 5 и на хромосоме 6 в области MHC.
Genetics of bronchial asthma
Authors discussed genetic component development of bronchial asthma. Candidate genes located on chromosomes 2, 4, 7, on a cluster of cytokines, on chromosome 5 and on chromosome 6 in the MHC.
Бронхиальная астма (БА) — заболевание с выраженной наследственной предрасположенностью. Дети, имеющие родственников первой линии родства с БА, имеют высокий риск развития клинических проявлений астмы [1]. Некоторые клиницисты большое внимание уделяют признакам мезенхимальной дисплазии как внешним маркерам генетических особенностей. У пациентов с БА часто встречаются множественные стигмы дисморфогенеза, патология соединительной ткани, кожные факомы. По итогам близнецовых исследований, генетический вклад в развитие БА оценивается в 30-70%.
Таблица 1.
Риск атопии у пробанда при достижении им возраста 7 лет в зависимости от наличия атопии в семейном анамнезе
| Семейный анамнез | Риск развития атопии (%) |
| Нет атопии | 10 |
| Один из родителей страдает атопией | 20 |
| Сиблинги страдают атопией | 35 |
| Оба родителя страдают атопией, но разными вариантами | 42 |
| Оба родителя страдают атопией, клиническая форма идентична | 75 |
БА — типичное заболевание мультифакториальной природы, развитие которого определяется взаимодействием наследственных факторов (мутаций или сочетаний аллелей) и факторов среды.
В последние годы генетические исследования при астме ведутся по нескольким направлениям: выявление вариантов генов, которые могут предсказать ответ на терапию, выявление вариантов генов, которые связаны с развитием болезни и играющих решающую роль в патофизиологии заболевания.
Верифицированы несколько групп генов-кандидатов, которые важны в развитии БА.
Гены атопии или гуморального иммунного ответа локализованы в участках хромосомы 5q24-33 и содержат кластер семейства генов цитокинов (IL-4, IL-5, IL-13, IL-3, GM-CSF), ответственный за развитие реакций немедленного типа (IgE-опосредованных реакций). IL-4, IL-13 экспрессируются Th-2 лимфоцитами и способствуют переключению В-клеток на синтез IgE. IL-5 и GM-CSF — цитокины, обеспечивающие созревание, выживание и хемотаксис эозинофилов. К этой группе также относят HLA-DR (гены молекул II класса МНС) — важные молекулы, участвующие в презентации антигена. Имеющиеся сегодня данные свидетельствуют, что полиморфизм генов интерлейкинов и их рецепторов является важным генетическим фактором возникновения БА и атопии [2, 3].
Гены рецепторных молекул (IL-4Rα, FcεRI β, ADRβ2). IL-4Rα — альфа цепь рецептора IL-4. Mitsuyasu et al. [4] сообщили о полиморфном варианте гена Ile50Val IL-4Rα цепи, наличие которого повышает синтез IgE и является одним из определяющих наследственных факторов возникновения атопической формы заболевания. В 17% случаев замена одного аминокислотного остатка (изолейцина лейцином в позиции 181) в гене, кодирующем β-субъединицу высокоаффинного рецептора к IgE (FcεRI β), приводит к развитию бронхиальной астмы. Однако аналогичные исследования, проведенные в Италии и Японии, такой закономерности не выявили.
Продукт ADRβ2 (гена β2-адренергического рецептора; 11q13) контролирует лабильность бронхов. Установлен полиморфизм гена ADRβ2 (Arg16Gly и Glu27Gln), определяющий повышенную вероятность развития тяжелой бронхиальной астмы. Более того, больные гомозиготные по этим вариантам гена быстро теряют чувствительность к β2-агонистам и требуют лечения гормональными препаратами [5]. Это является одним из достижений в фармакогенетике БА. Причем ген рецептора IL-4 (IL4RA) и ген, кодирующий β-субъединицу высокоаффинного рецептора к IgE (FcεRI β), могут быть отнесены к генам атопии, а ген ADRβ2 — к генам бронхиальной гиперреактивности.
Южнокорейскими учеными [6] выявлены 2 полиморфных гена CRTH2, экспрессирующихся на поверхности эозинофилов, с однонуклеотидными заменами -466T>C и -129C>A, которые тесно связаны с инфильтрацией эозинофилами дыхательных путей у больных с аспирин-индуцированной БА. Гены факторов транскрипции — STAT6, JAK1, JAK3 [7] ассоциированы с наличием БА. Последний мета-анализ объединил результаты 11 исследований [8]. Выявлены хромосомные регионы, содержащие ведущие гены восприимчивости к БА, при использовании самых строгих статистических критериев. К ним относятся 6p22.3-p21.1 (гиперактивность бронхов), 5q11.2-q14.3 и 6pter-p22.3 (концентрация общего IgE), 3p22.1-q22.1, и 17p12-q24.3 (положительный кожный тест). Однако никакой преобладающей ассоциации среди указанных регионов не обнаружено, что объясняет гетерогенность болезни и вариабельность диагноза в разных популяциях разных стран.
Признано, что многочисленные гены взаимодействуют между собой при БА и атопии, повышая или уменьшая риск развития болезни. При наличии генов, кодирующих IL-13 и IL-4RA (обе ключевые молекулы в Th-2 сигнализации), выявлен в 2,5 раза больший риск развития БА, чем у индивидуумов с наличием одного гена. Исследование четырех генов показало, что комбинация определенного однонуклеотидного полиморфизма (SNPs) в IL-13, IL-4, IL4RА, и STAT 6 сопровождается 16,8-кратным увеличением риска БА. Эти сведения указывают на значение изучения взаимодействия генов при сложных болезнях и объясняют их роль в развитии и прогрессировании болезни.
Имеется предположение, что эндогенная БА — аутоиммунное заболевание, опосредованное аутоантителами к эпителиальному антигену. Не исключено, что появление аутоантител связано с генетически обусловленным дефицитом антиоксидантной системы. Свободные радикалы способны превращать макромолекулы в аутоантигены. На их возникновение иммунная система отвечает выработкой специфических аутоантител. В организме запускается аутоиммунный процесс, который в конечном итоге и приводит к БА. В этой связи относительно недавно обнаружена субпопуляция T-хелперов, названная Th17 [9], играющая значимую роль при аутоиммунных заболеваниях.
IL-17 является эффекторным цитокином, который продуцируют Th17 клетки, и его повышенная концентрация выявлена в слюне больных БА [10]. Однако имеются исследования [11] о варианте гена IL-17, His161Arg, который ассоциирован с протективным эффектом при астме. В 2009 году обнаружены новые гены восприимчивости к БА, не связанные с иммунной системой. Полиморфизм генов хитиназы и хитиназоподобных белков CHIT1, CHIA, CHI3L1 сочетается с риском БА.
Относительно недавно был охарактеризован первый позиционно клонированный ген астмы ADAM33 [12] на хромосоме 20p13. Анализ 135 однонуклеотидных полиморфизмов в 23 из них показал наиболее существенную ассоциацию заболевания с вариантом гена ADAM33, который кодирует металлопротеазу, играющую важную роль в функционировании гладких мышц бронхов и фибробластов легкого. Эти данные свидетельствуют о важной роли ADAM33 в ремоделировании дыхательных путей. В настоящее время роль этих генетических вариаций, связанных с восприимчивостью к астме, подтверждена в Саудовской Аравии, Китае [13]. В локусе хромосомы 1q31 в 2010 году был идентифицирован ген DENND1B, который экспрессируется натуральными киллерами и дендритными клетками, кодирует белок, взаимодействующий с рецептором фактора некроза опухоли, и связан с развитием БА [14].
Гены-модификаторы (GSTM1, GSTT1, CYP2E1, NAT2, SLC11A1). На сегодняшний день известно, что в патологии БА принимают участия белковые продукты генов системы детоксикации ксенобиотиков. Недавними исследованиями Сардарян И.С. [15] изучены фенотипические особенности БА при аллельном полиморфизме генов глутатион-S-трансферазы Т1 (GSTT1), глутатион-S-трансферазы М1 (GSTM1), ангиотензин превращающего фермента (ACE), эндотелиальной синтазы оксида азота (eNOS). Выявлено, что ассоциация генотипов GSTT1-GSTM1‑ повышает в 5 раз риск развития БА у детей по сравнению с популяцией. У детей при функционально активном генотипе GSTT1+GSTM1+ в ассоциации с полиморфизмом II по гену АСЕ риск развития БА снижается в 7 раз, что позволяет считать данную ассоциацию генотипов протективной.
В заключение можно указать, что к развитию астмы причастны много генов, расположенных на разных хромосомах. Прежде всего это генный комплекс HLA на 6-й хромосоме. Кроме того, с развитием БА связаны:
- локусы 2 pter*
- 2q6 (реакция на домашних клещей)
- 2q33 (CD28; белок, связывающий инсулиноподобный фактор)
- 3p24.2-p22 (С-С рецептор хемокина)*
- 4q35 (интерферонорегулирующий фактор-2)*
- 5q15 (ген не идентифицирован)
- 5q23-q33 (IL-3; IL-4; IL-5; IL-9; IL-13; глюкокортикоидный рецептор)**
- 5q31 (гены регуляции IgE). В непосредственной близости расположены гены бронхиальной гиперреактивности и адренергических b2 рецепторов
- 6p21.1-p23 (HLA, фактор некроза опухолей α)*
- 7р15.2 (Т-клеточный рецептор G, IL-6)*
- 9q31.1 (тропомиозин связывающий белок)*
- 11р15 (ген не идентифицирован)
- 11q13 (ген b-цепи высоко аффинного IgE рецептора, триггер аллергических реакций на мастоцитах, передается по материнской линии, отцовский «импринтинг» вероятен)**
- 12q (синтаза оксида азота)
- 12q14-q24.33 (сигнальный кондуктор и активатор транскрипции 6; интерферон γ; фактор стволовых клеток; инсулин-подобный фактор роста 1; лейкотриен А4 гидролаза; β субъединица ядерного фактора Y; В-клеточный транслокационный ген 1)**
- 13q14.3-qtep (трансляционно контролируемый протеин-1 опухоли)*
- 16q22.1-q24.2 (ген не идентифицирован)
- 17p11.1-q11.2 (хемокиновый кластер)
- 19q13 (CD22)
- 21q21 (ген не идентифицирован)
- Xq28/Yq28 (рецептор IL-9)
—————————————————
Примечание:
* — общие гены с атопией; ** — общие гены с атопией и атопическим дерматитом
Данный перечень генов, ответственных за развитие БА, не полон. Не упомянуты гены, участвующие в ремоделировании дыхательных путей, гетерогенна и гиперреактивность дыхательных путей. Все это делает понятным клинический полиморфизм заболевания.
Будет ли возможно в будущем предсказать развитие БА, базируясь на генетическом тестировании? Предсказующая величина тестирования единственного гена при полигенном наследовании болезни очень ограничена как для диагностики, так и в профилактических целях. В будущем прогноз астмы, возможно, будет основываться на оценке комплекса генов, персональных факторов и факторов риска окружающей среды, вместе содействующих развитию, персистенции, прогрессированию или ремиссии БА [16, 17].
Ю.И. Будчанов, В.М. Делягин
Тверская государственная медицинская академия
Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии, г. Москва
Будчанов Юрий Иванович — кандидат медицинских наук, доцент кафедры клинической иммунологии с аллергологией Тверской государственной медицинской академии.
Литература:
1. Burr M., Merrett T., Dunstan F., Maguire M. The development of allergy in high-risk children // Clinical and Experimental Allergy, 1997. — v. 27. — Р. 1247-1252.
2. Фрейдин М.Б., Огородова Л.М., Пузырев В.П. Вклад полиморфизма генов интерлейкинов в изменчивость количественных факторов риска атопической бронхиальной астмы // Мед. генетика, 2003. — Т. 2. — № 3. — С. 130-135.
3. Фрейдин М.Б., Брагина Е.Ю., Огородова Л.М., Пузырев В.П. Генетика атопии: современное состояние. // Вестник ВОГиС, 2006. — Том 10. — № 3 — С. 492-503.
4. Mitsuyasu H., Izuhara K., Mao X.-Q. et al. Ile50Val variants or IL4Ra upregulates IgE synthesis and associates with atopic asthma // Nat. genet., 1998. — v. 19. — Р. 119-120.
5. Wechsler M., Lehman E., Lazarus S. et al. National Heart, Lung and Blood Institute’s Asthma Clinical Research Network. beta-Adrenergic receptor polymorphisms and response to salmeterol //American Journal Respir. Crit. Care Medicine, 2006. — v. 173. — P. 519-526.
6. Palikhe N., Kim S-H., Cho B-Y. et al. Genetic variability in CRTH2 polymorphism increases eotaxin-2 levels in patients with aspirin exacerbated respiratory disease // Allergy, 2010. — v. 65. — Р. 338-346.
7. Moller M., Gravenor M., Roberts S. et al. Genetic haplotypes of Th-2 immune signalling link allergy to enhanced protection to parasitic worms. // Human Molecular Genetics, 2007. — v. 16. — Р. 1828-1836.
8. Denham S., Koppelman G, Blakey J. et al. Meta-analysis of genome-wide linkage studies of asthma and related traits // Respir. Research, 2008. — v. 9. — р. 38.
9. Weaver C., Hatton R., Mangan P., Harrington L. IL-17 family cytokines and the expanding diversity of effector T cell lineages // Annual Revy Immunology, 2007. — 25. — Р. 821-852.
10. Bullens D., Truyen E., Coteur L. et al. IL-17 mRNA in sputum of asthmatic patients: linking T cell driven inflammation and ranulocytic influx? // Respir. Res., 2006. — v. 7. — Р. 135.
11. Kawaguchi M., Takahashi D., Hizawa N. et al. IL-17F sequence variant (His161Arg) is associated with protection against asthma and antagonizes wild-type IL-17F activity // Journal of Allergy and Clinical Immunology, 2006. — v. 117. — Р. 795-801.
12. Van Eerdewegh P., Little R., Dupuis J. et al. Association of the ADAM33 gene with asthma and bronchial hyperresponsiveness // Nature, 2002. — v. 418. — Р. 426-430.
13. Bazzi M., Al-Anazi M., Al-Tassan N.A. et al. Genetic variations of ADAM33 in normal versus asthmatic Saudi patients // https://biotechcentersa.org/asthma-genetics/.
14. Sleiman P., Flory J., Imielinski M. et al. Variants of DENND1B associated with asthma in children // New England Journal of Medicine, 2010. — v. 362. — Р. 36-44.
15. Сардарян И.С. Фенотипические особенности бронхиальной астмы у детей при различных аллельных полиморфизмах генов «предрасположенности» (GSTТ1, GSTМ1, ACE, eNOS) / Автореф. дисс. к.м.н. — СПб, 2009. — 22 с.
16. Koppelman G., te Meerman G., Postma D. Genetic testing for asthma // Eur. Respir. J., 2008. — v. 32. — Р. 775-782.
17. Postma D., Koppelman G. Genetics of asthma: where are we and where do we go? // The Proceedings of the American Thoracic Society, 2009. — v. 6. — Р. 283-287.
Источник