Эмболия легких при астме
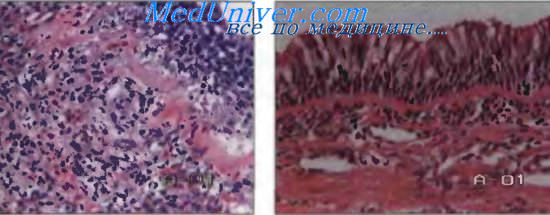
Бронхиальная астма. Изменения легких при бронхиальной астме.Бронхиальная астма — хроническое воспалительное заболевание дыхательных путей, в котором принимают участие тучные клетки (ТК), эозинофилы и Т-лимфоциты; это заболевание характеризуется повторяющимися эпизодами хрипов, одышки, тяжести в грудной клетке, кашлем, особенно ночью и/или ранним утром; такие симптомы сопровождаются распространенной вариабельной обратимой обструкцией бронхиального дерева, разрешающейся спонтанно или под влиянием лечения. Наиболее полные морфологические данные о состоянии бронхов и легочной ткани были получены при аутопсиях больных, умерших на высоте астматического приступа. При этом макроскопически выявляется острое вздутие легких, часто сочетающееся с эмфиземой, легкие выполняют всю грудную полость, очень часто на поверхности легких видны отпечатки ребер. Высота стояния диафрагмы определяется, как правило, на уровне 6-го ребра. Поверхность легких обычно бледно-розового цвета, на разрезе — темно- или серо-красные. Пневмосклероз, как правило, бывает выражен умеренно. Выявляется утолщение выступающих над поверхностью разрезов стенок бронхов, практически все генерации бронхов вплоть до респираторных бронхиол заполнены густыми серовато-желтыми стекловидными слепками мокроты (бронхиального секрета), которые выдавливаются в виде тонких «червячков».
Слизистая оболочка бронхов почти на всем протяжении гиперемирована. Как правило, выражен отек легких, иногда встречается тромбоэмболия легочной артерии и/или ее ветвей. При гистологическом исследовании в расширенных просветах бронхов определяются слизистые пробки, пласты слущенного эпителия с примесью нейтрофилов, эозинофилов, лимфоцитов, почти полное оголение базальной мембраны, иногда встречаются кристаллы Шарко-Лейдена. В сохраненном эпителии увеличенное число бокаловидных клеток. Инфильтраты в стенках бронхов состоят преимущественно из эозинофилов. Обнаруживают расширение и резкое полнокровие капилляров слизистой оболочки и подслизистого слоя. Базаль-ная мембрана обычно неравномерно толщена до 5 мкм, часто видны отдельные проходы в ней, перпендикулярные к просвету бронха, очаговая резорбция отдельных участков базальной мембраны. В настоящее время считают, что это следствие действия эозинофильного каионного и основного щелочного белков! эозинофилов. По данным иммуноморфологии в утолщенных участках базальной мембраны повышена концентрация глобулинов, коллагенов II, III, IV типов, фибронектина, продуцируемого пролиферирующими фибробластами. Кроме того, в базальной мембране наблюдали диффузное расположение сывороточного альбумина и фибриногена. Электронномикроскопически было показано, что базальная мембрана состоит из двух компонентов: собственно базальной мембраны толщиной 0,8 мкм, которая отделена от эпителия светлой зоной толщиной 0,6 мкм, и широкой зоны, прилежащей к строме, состоящей из коллагеновых и тонких параллельных волокон. Большинство исследователей считаем что утолщение базальной мембраны связано с отложением иммунных комплексов. Подслизистый слой почти на всем протяжении густо инфильтрирован полинуклеарами и эозинофилами. Наблюдается выраженный отек стромы полнокровие расширенных капилляров. Выявляется гиперплазия желез и перепол нение их ШИК-положительным материалом. Относительно состояния мышечной оболочки данные противоречивы. Часть авторов сообщает о гипертрофии и дистрофии миоцитов, однако при морфометрическом исследовании объемная плотность зачастую не отличается от контрольных значений, что связано с выраженным отеком стенки. В периферической легочной ткани имеет место выраженное расширение респираторных бронхиол, альвеолярных ходов и альвеол, определяется внутриальвеолярный и интерстициальный отек, в просветах альвеол обнаруживается небольшое число альвеолярных макрофагов и эозинофилов. Описанные выше изменения встречаются, как правило, у умерших с анамнезом бронхиальной астмы не более 5 лет. У больных с длительным анамнезом БА к изменениям в бронхах и легочной ткани примешиваются элементы хронического продуктивного воспаления. На основании изучения бронхобиопсий ряд исследований последних лет позволил оценить состояние бронхиальной стенки в межприступный период. Эти изменения схожи с изменениями бронхов при экспериментальных моделях в межприступный период. В настоящее время имеются данные о том, что при анализе материала бронхобиопсий возможна оценка фазы заболевания. Было показано, что в просвете бронха обнаруживаются клетки десквамированного эпителия, тельца Креолы, ассоциации нейтрофилов, лимфоцитов и эозинофилов. Увеличено число бокаловидных клеток, утолщена базальная мембрана , выявляется гиперплазия желез, расширение и полнокровие сосудов подслизистого слоя, в толще стенки увеличено число эозинофилов, лимфоцитов, нейтрофилов и ТК, единичные эозинофилы в эпителии. Состояние мышечной оболочки не всегда одинаковое. Часто наблюдают гипертрофию и контрактуры мышечных клеток, однако это непостоянный признак, иногда встречаются мышечные клетки в состоянии зернистой или жировой дистрофии. Остаются некоторые спорные вопросы морфологии отдельных элементов стенки. До сих пор существует лишь один критерий бронхоспазма — обнаружение в просветах бронхов не заполненных слизью пластов десквамированного эпителия. В эксперименте обнаружен еще один признак бронхоспазма — циркулярное смещение хрящевых пластинок и захождение их одна за другую. В более ранних публикациях за критерий бронхоспазма принимали гофрирован ность эпителиального пласта в виде «звездочки» и перпендикулярное расположение округлых пучков мышечных волокон, однако эти изменения встречаются и у других умерших при отсутствии клиники бронхоспазма. Поскольку бронхоспазм является одним из пусковых механизмов БА и повторно возникает в поздней стадии приступа при наличии уже в просвете слизистых пробок, то на секции, которая, как правило, проводится спустя 6 ч после наступления смерти, когда уже начинает разрешаться трупное окоченение, достоверных признаков бронхоспазма обнаружить практически невозможно. Вероятно, ранние вскрытия в пределах первых 2 ч после смерти позволят обнаружить достоверные критерии бронхоспазма. — Вернуться в оглавление раздела «Пульмонология.» Оглавление темы «ХОБЛ. Бронхиолит. Бронхоэктазы.»: |
Источник
Легочная эмболия – это осложнение, которое часто создает серьезную угрозу для жизни. Инфаркт легкого является следствием блокировки просвета легочной артерии. Это состояние проявляется внезапным приступом удушья, дыхание становится поверхностным и быстрым.
Иногда возникает тупая боль за грудиной и сильное беспокойство. Также может появляться лихорадка и кашель. Симптомы инфаркта легкого довольно похожи на симптомы инфаркта миокарда.
Причины легочной эмболии и инфаркта легкого
Легочная эмболия образуется, когда происходит резкое перекрытие протока легочной артерии или ее ветви. Легочная артерия, которая делится на левую и правую, обеспечивает доставку венозной крови из правого желудочка сердца в легкие, где кровь выделяет не нужные газы и насыщается кислородом.
Ткань легких под …
Закупорка в легочной артерии, как правило, является следствием тромбоза глубоких вен, в основном, нижних конечностей. Чтобы образовался затор, тромб должен отделиться от стенок вен и с током крови переместить в правую часть сердца, а затем в легочную артерию. Если в ходе тромбоза глубоких вен возникает легочная эмболия, то говорят о венозной тромбоэмболии.
Эмболия легких является причиной около 7% смертей в больницах Соединенных Штатов. Смертность от этой болезни достигает 30%.
Повышенный риск возникновения закупорки легочной артерии возникает у людей, которые имеют склонность к образованию сгустков крови в сосудах, т.е. у тех, которые:
- долго лежат в постели: это очень существенный фактор риска тромбоза глубоких вен и легочной эмболии, поэтому врачи всегда стараются как можно быстрее подымать на ноги пациентов после операции;
- страдают от недостаточности сердечной мышцы или болезни крови, облегчающей процесс свертывания;
- страдают ожирением;
- прошли серьезные хирургические операции, особенно в области нижних конечностей и брюшной полости;
- болеют злокачественным раком;
- имеют общее заражение;
- перенесли в последнее время тяжелую травму, особенно полиорганную или перелом таза, ближайшей части бедренной кости и других длинных костей нижних конечностей, повреждения спинного мозга связанное с параличом нижних конечностей и длительной неподвижностью;
- имеют повышенную склонность к образованию тромбов, врожденную или приобретенную;
- болеют болезнью Крона или неспецифическим язвенным колитом;
- имеют случаи легочной эмболии в семейной истории;
- имеют варикозное расширение вен нижних конечностей (само варикозное расширение вен не являются фактором риска, но оно усиливает воздействие других факторов риска тромбоза).
Кроме того, риск возрастает, если эти факторы возникают у человека в возрасте старше 40 лет. Кроме того, особую группу риска представляют беременные и женщины в послеродовой период. Увеличение свертываемости крови может возникнуть также у лиц, принимающих лекарства, а также гормональные методы контрацепции (особенно в сочетании с курением). Риск возрастает при использовании гормональной заместительной терапии (таблетки) или приеме селективных модуляторов эстрогеновых рецепторов, например, тамоксифен, ралоксифен.
До недавнего времени легочную эмболию делили на массивную, субмассивную и немассивную. С некоторых пор функционирует новая и улучшенная классификация этого заболевания. Теперь эмболию классифицируют, как заболевание высокого риска (риск смерти оценивается выше 15%) и невысокого риска. В рамках эмболии невысокого риска выделяют состояния промежуточного риска, когда угроза смерти составляет 3-15%, и легочную эмболию низкого риска с вероятностью смерти ниже 1%.
Кроме тромбов, вызвать закупорку легочной артерии могут также:
- околоплодные воды (например, после преждевременной отслойки плаценты);
- воздух (например, при введении катетера в вену или его удалении);
- жировая ткань (например, после перелома длинной кости);
- опухолевые массы (например, при раке почки или раке желудка);
- инородное тело (например, материал, используемый для эмболизации сосудов).
Симптомы и диагностика легочной эмболии и инфаркта легкого
Легочная эмболия проявляется, как правило, через внезапную сильную боль в груди (примерно у половины больных), появляется одышка (более чем 80% пациентов), ускорение дыхания (у 60% пациентов). Кроме того, иногда возникают проблемы с сознанием или даже обморок (кратковременная потеря сознания). Часть пациентов испытывает ускорение ритма сердца (выше 100 ударов в минуту).
В более тяжелых случаях, когда забита большая ветвь артерии, может произойти падение артериального давления (гипотония) и даже шок. Иногда наблюдается кашель (довольно сухой при эмоболии и с кровянистыми выделениями при инфаркте легкого). Кроме того, в ходе легочной эмболии может возникать лихорадка, кровохарканье (у 7%), потливость, ощущение страха. При таких признаках необходимо как можно быстрее вызвать скорую помощь.
Иногда диагностировать эмболию довольно затруднительно, так как симптомы, перечисленные выше, появляются также и при других заболеваниях, таких как воспаление легких или инфаркт. Симптомы также могут быть слабо выраженными и это вводит в заблуждение. Между тем легочная эмболия является состоянием, угрожающим жизни и требует строго стационарного лечения. Многие люди, у которых происходит закупорка легочной артерии, умирают. В тех случаях, когда не доходит до смерти, увеличивается риск повторной эмболии, такие люди должны быть постоянно под контролем врача.
Если клинические проявления указывают на легочную эмболию, также рекомендуется выполнить ультразвуковое исследование вен нижних конечностей. Если в этом исследовании обнаруживают наличие тромбов в венозной системе нижних конечностей, это почти на 100% подтверждает диагноз.
Легочную эмболию всегда необходимо отличать, прежде всего, от:
- заболеваний легких, т.е. астма, хроническая обструктивная болезнь легких (обострение), плевральный пневмоторакс, воспаление легких и плевры, синдром острой дыхательной недостаточности;
- заболеваний сердечно-сосудистой системы, таких как инфаркт миокарда, сердечная недостаточность;
- невралгии межреберного нерва.
Поставить диагноз легочная эмболия иногда очень сложно. Чтобы помочь врачам был создан тест Wellsa. Он представлен ниже. За утверждение каждого из указанных заболеваний начисляется определенное количество баллов:
- Перенесенное в прошлом воспаление глубоких вен или эмболия легких (1,5 балла).
- Недавно проведенная хирургическая операция или иммобилизация (1,5 балла).
- Злокачественная опухоль (1 балл).
- Кровохарканье (1 балл).
- Сердцебиение выше 100 уд/мин (1,5 балла).
- Симптомы воспаления глубоких вен (3 балла).
- Вероятность других диагнозов ниже, чем легочная эмболия (3 балла).
- 0-1: клиническая легочная эмболия маловероятна;
- 2-6: промежуточная вероятность клинической легочной эмболии;
- выше или равна 7: высокая вероятность клинической легочной эмболии.
Лечение легочной эмболии
Метод лечения легочной эмболии зависит от степени тяжести заболевания. В самых тяжелых случаях, связанных с большим риском смерти, применяется тромболитическая терапия или лечение препаратами, которые активируют растворение тромбов крови.
Чаще всего используется альтеплаза или стрептокиназа. Эти препараты вводят внутривенно во время острой фазы заболевания. После их ввода добавляют, как правило, гепарин, то есть вещество предотвращает свертывание крови.
После стабилизации состояния пациента, дают еще один тип препарата – аценокумарол. Этот препарат действует через замедление производства факторов свертывания в печени. Это приводит к снижению. Этот препарат применяется затем постоянно, иногда до конца жизни.
В менее тяжелых случаях эмболии, на первом этапе достаточно лечения гепарином, без тромболитических препаратов, применение которых связано с риском серьезных осложнений (внутричерепные кровотечения у 3%).
Кроме того, в лечении легочной эмболии иногда применяются инвазивные методы: эмболектомия или установка фильтра в главной нижней вене. Эмболектомия заключается в физическом удалении тромбов из легочных артерий. Эта процедура применяется только в тех случаях, когда легочная эмболия очень тяжелая и существуют противопоказания к классической терапии, например, кровотечения из внутренних органов или перенесенные в прошлом внутричерепные кровотечения.
Эмболектомию выполняют также и в том случае, когда проведение тромболитической терапии оказалось неэффективным. Чтобы можно было провести эмболектомию, требуется использование систем искусственного кровообращения. Но, так как эта процедура обременительна для организма, на нее решаются в крайних случаях.
Фильтр вставляют в главную нижнюю вену с целью блокировать проход эмболического материала от нижних конечностей к сердцу и легким. Используется у больных с подтвержденным тромбозом глубоких вен нижних конечностей, у которых невозможно применить тромболизис, потому что имеются критические противопоказания, либо тромболитическая терапия является неэффективной.
Осложнение легочной эмболии – инфаркт легкого
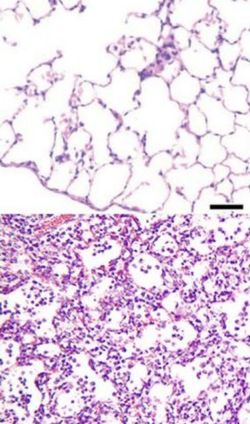
Когда дело доходит до закупорки ветвей легочной артерии, может возникнуть инфаркт легких. Это осложнение касается 10-15% больных легочной эмболией. Инфаркт легкого происходит при перекрытии малых сердечно-легочных сосудов (диаметром меньше 3 мм) и при наличии сопутствующих дополнительных факторов (о чем ниже). Инфаркт легкого – это очаг некроза в легочной ткани, возникающий вследствие недостаточного поступления кислорода к данной «местности» – аналогично инфаркту миокарда.
Это редкое осложнение легочной эмболии, потому что легкие васкуляризированы через две системы – малый круг кровообращения и ветви бронхиальной артерии. Когда одна из систем, доставляющих кислород, подводит, вторая, по крайней мере, частично компенсирует снижение доставки кислорода. На практике, инфаркт легкого обычно возникает у пожилых людей, которые страдают, кроме того, от недостаточности левого желудочка, а также у тех, чьи легкие уже страдают какой-то болезнью: рак, ателектаз, пневмоторакс, воспаление.
Если легочная эмболия осложняется инфарктом легких, симптомы последнего появляются в течение нескольких часов. Это сильная боль в груди (особенно во время вдоха) и кашель, нередко-с кровянистыми выделениями. Иногда присоединяется лихорадка. Зона некроза, как правило, располагается на периферии легких, в основном, в пределах нижней левой или правой доли. Более чем в половине случаев их больше, чем один.
Лечение инфаркта легкого заключается прежде всего в устранении легочной эмболии. Необходима подача кислорода и предотвращение заражения омертвевших тканей.
Стоит помнить о других возможных причинах возникновения инфаркта легкого, таких как:
- серповидно-клеточная анемия;
- воспалительные заболевания сосудов;
- инфекции в рамках сосудов;
- затор, вызванный раковыми клетками, которые могли попасть в сосуды.
Симптомы инфаркта легкого могут напоминать сердечный приступ. В любом случае, их не следует недооценивать.
Источник
Прогноз
- Стратификация риска и прогноз
В новом руководстве Европейского общества кардиологов (ЕОК) под тяжестью ТЭЛА понимается риск ранней смерти (смерти в стационаре или в течение 30 суток после эмболии). Поэтому рекомендовано отказаться от использовавшихся ранее терминов «массивная», «субмассивная» и «немассивная» ТЭЛА, которые характеризуют только анатомический объём обструкции и могут неверно отражать прогноз, и заменить их на оценку риска ранней обусловленной ТЭЛА смерти [41]. Исходя из этих позиций, «большим» ТЭЛА будут соответствовать комбинации размера эмболов и функционального состояния сердца и лёгких, приводящие к значимому нарушению гемодинамики [20]. Предлагается использовать стратификацию больных на группы высокого и невысокого риска, а среди последних выделять подгруппы среднего и низкого риска [41].
Оценка степени риска лежит в основе выбора тактики ведения больных ТЭЛА (см. «
диагностический алгоритм при подозрении на ТЭЛА
», «
алгоритм лечения ТЭЛА
»).
Критерии стратификации риска приведены в таблице 30, в таблице 4 – алгоритм стратификации риска и соответствующей тактики ведения больных ТЭЛА.
Таблица 30. Основные критерии стратификации риска при ТЭЛА [41].

Клинические признаки
Шок
Гипотонияa
Признаки дисфункции правого желудочка
- Гипокинез правого
желудочка, дилатация его полости, эхокардиографические признаки перегрузки
давлением (см раздел «диагностика ТЭЛА» — «эхокардиография»). - Дилатация правого желудочка по данным спиральной КТ (см.
раздел «диагностика ТЭЛА» — «КТ-ангиография»,
рис. 33). - Повышение
уровня BNP (МНУП — мозгового
натрий-уретического пептида) или его предшественника NT-proBNP (N-концевой
МНУП). - Повышение давления в правых отделах сердца по данным
катетеризации сердца.
Показатели повреждения
миокарда
Повышение уровня сердечных
тропонинов T или Ib
a
Определяется, как систолическое АД
b
В последнее время
в качестве маркера повреждения миокарда также обсуждается миокардиальный
белок, связывающий жирные кислоты (H-FABP), однако для определения его роли
необходимы дальнейшие исследования.Таблица 4. Стратификация риска в соответствии с ожидаемой ранней
летальностью вследствие ТЭЛА [41].

Группы риска ранней смерти (смерти в стационаре или в течение 30 суток
после ТЭЛА)
Факторы риска
Тактика ведения
Клинические (шок, гипотония)
Дисфункция правого желудочка (хотя бы 1 признак)
Повреждение миокарда
(хотя бы 1
показатель)
ВЫСОКОГО > 15% + (+) a
(+) a
Тромболизис или эмболэктомия НЕВЫСОКОГО Среднего
3-15%— + + Лечение в стационаре + — — + Низкого — — — Ранняя выписка или амбулаторное лечение a
Для
стратификации риска при шоке и гипотонии нет необходимости в подтверждении
дисфункции правого желудочка и повреждения миокарда – больные автоматически
относятся к категории высокого риска.В первую очередь необходимо разделить больных на группы высокого и невысокого риска на основании простой клинической оценки состояния больного. При шоке или артериальной гипотонии (систолическое АД
Остальные входят в группу невысокого риска, для дальнейшей классификации на подгруппы промежуточного и низкого риска необходимо проведение дополнительных исследований.
Таким образом, уже при быстром обследовании у постели больного можно определить, относится пациент к группе высокого риска ранней смерти или нет. Такой подход позволяет в кратчайшие сроки определиться с тактикой ведения больных и своевременно назначить жизнеспасающее лечение больным высокого риска. При дальнейшем обследовании тех, у кого нет клинических признаков высокого риска (шока, артериальной гипотонии), следует оценить риск более точно [41].
Подробнее

Кроме перечисленных в таблице 30 критериев дисфункции правого желудочка следует обращать внимание на такой симптом, как расширение вен шеи (если это не связано с тампонадой сердца или опухолями средостения). Систолический шум над трёхстворчатым клапаном и ритм галопа – более субъективные признаки. Можно учитывать также ЭКГ-критерии перегрузки правого желудочка (инверсия зубцов Т в отведениях V
1
-V
4
, комплекс типа QR в отведении V
1
, а также такие классические признаки, как полная или неполная блокада правой ножки пучки Гиса и сочетание S
I
Q
III
T
III
), однако они обладают низкой чувствительностью. Катетеризация правых отделов сердца позволяет непосредственно измерить давление наполнения правого желудочка и сердечный выброс, однако рутинное использование данного метода только лишь для стратификации риска не рекомендуется.
К ЭхоКГ критериям плохого прогноза помимо перечисленных в таблице 30 относится обнаружение открытого овального окна при клиническом подозрении на ТЭЛА. При этом помимо ухудшения общего прогноза повышается риск инсультов (парадоксальная эмболия) [28].
КТ грудной клетки с контрастным усилением (КТ-ангиография) в последнее время стала методом выбора визуализации тромбов в лёгочной артерии, она лежит в основе диагностического алгоритма при ТЭЛА невысокого риска. Помимо оценки состояния сосудов малого круга после внутривенного введения контрастного препарата КТ позволяет оценить соотношение размеров желудочков (рис. 33). Отношение ПЖ/ЛЖ > 1 свидетельствует о дилатации правого желудочка. Прямых данных о функции правого желудочка КТ не даёт.
Наличие проксимального тромбоза глубоких вен (ТГВ) повышает риск рецидивирования венозного тромбоэмболизма (ВТЭ) у больных ТЭЛА, поэтому УЗИ глубоких вен может использоваться для стратификации риска.
Повышение
уровня BNP (МНУП — мозгового натрий-уретического пептида) или его предшественника NT-proBNP (N-концевой МНУП)
у больных ТЭЛА свидетельствует о дисфункции правого желудочка. Предсказательная ценность положительного результата невысока, однако низкий уровень BNP или NT-proBNP – показатель хорошего прогноза (предсказательная ценность отрицательного результата 94%-100%).
В ряде случаев смерти от массивной ТЭЛА при аутопсии обнаруживается трансмуральный инфакрт правого желудочка, несмотря на достаточную проходимость коронарных артерий. Хотя источником повышения сердечных тропонинов не обязательно является миокард правого желудочка, этот признак существенно ухудшает прогноз больных ТЭЛА. Повышение уровня тропонина Т более 0.1 мг/мл определяется в 0-35-50% случаев при немассивной, субмассивной и массивной ТЭЛА соответственно. Повышенный уровень тропонина увеличивает риск летального исхода даже среди больных с сохранной гемодинамикой (относительный риск 5.9). Больничная летальность от ТЭЛА при позитивном тесте на тропонин Т составляет 48% по сравнению с 3% — при отрицательном. Более того, уровень тропонина Т > 0.01 нг/мл связан с возрастанием летальности. Повышение уровня тропонинов I и Т ассоциируется также с осложнённым течением заболевания. Рекомендуется определять уровень тропонина при поступлении и спустя 6-12 часов, так как исходно отрицательный результат может перейти в положительный.
В последнее время в качестве маркера повреждения миокарда предлагается миокардиальный белок, связывающий жирные кислоты (H-FABP). Использование этого показателя для стратификации риска ТЭЛА при поступлении даже эффективнее, чем определение уровней миоглобина или тропонинов. Если за пороговое значение принять уровень H-FABP 6 нг/мл, то в отношении прогноза ранней смерти от ТЭЛА предсказательное значение положительного результата составит 23-37%, а предсказательное значение отрицательного результата 96-100%. Однако для определения его роли необходимы дальнейшие исследования.
Анализ значений нескольких показателей в совокупности повышает их прогностическую ценность. Так летальность от ТЭЛА в течение 40 дней среди больных с одновременным повышением уровня тропонина Т и NT-proBNP составила 30%, в то время как при изолированном повышении NT-proBNP – 3.7%. В другом исследовании сочетание повышения тропонина I > 0.1 нг/л и отношения размеров ПЖ/ЛЖ > 0.95 по данным ЭхоКГ ассоциировалось с 30-дневной летальностью 38%. Сохранная функция правого желудочка при нормальном уровне перечисленных биомаркеров – очень хороший прогностический признак.
Отсутствие общепринятых пороговых уровней для биомаркеров (в связи с недостатком доказательных данных) существенно ограничивают возможности их использования для обоснования той или иной терапевтической стратегии у больных ТЭЛА невысокого риска. Пролить свет на этот вопрос призвано проводимое сейчас многоцентровое рандомизированное исследование. Оно посвящено оценке эффективности тромболитической терапии у больных с нормальным АД, но с ЭхоКГ признаками дисфункции правого желудочка и повышенным уровнем тропонинов [41].
Данные, получаемые в процессе клинического обследования, и результаты простых лабораторных анализов также могут использоваться для оценки прогноза. Многие из них связаны с фоновыми и сопутствующими заболеваниями. Так, согласно регистру ICOPER к неблагоприятным прогностическим факторам относятся онкологические заболевания,
сердечная недостаточность
, ХОБЛ и возраст старше 70 лет [41]. Имеющиеся до эмболии заболевания сердца и лёгких ассоциированы с 4-7 кратным увеличением смертности от ТЭЛА. Таким образом, на прогноз ТЭЛА существенно влияет исходный сердечно-лёгочный статус [20]. В качестве предикторов риска предлагаются также
уровень креатинина
,
D-димера
, ТГВ в анамнезе, подтверждённый при УЗИ ТГВ, артериальная гипоксемия и др.
В руководстве ЕОК по диагностике и лечению ТЭЛА (2008) приводится шкала, по которой больные ТЭЛА могут быть разделены на 5 подгрупп в зависимости от риска смерти в первые 30 дней (таблица 31) [41].
Таблица 31. Показатели рутинных методов
обследования — предикторы смерти от всех причин в течение 30 дней после эпизода
ТЭЛА [41].

Показатель
Баллы
Возраст 1 балл на
каждый год жизниМужской пол 10 Онкологическое
заболевание30 Сердечная
недостаточность10 Хроническое
заболевание лёгких10 ЧСС > 110
/мин20 САД 30 ЧДД ≥ 30/мин 20 Температура
тела20 Спутанность
сознания (вплоть до комы)60 SaO 2
20 Категории
риска – сумма баллов (30-дневная летальность от всех причин, %):- Класс I –
менее 65 (0%). - Класс II –
66-85 (1%). - Класс III –
86-105 (3.1%). - Класс IV –
106-125 (10.4%). - Класс V –
более 125 (24.4%).
К категории низкого риска относятся классы I и II (0-1%).
SaO2
– сатурация кислорода (пульсоксиметрия).
Кроме того, на прогноз ТЭЛА влияет быстрота распознавания и начала терапии. Так, Без лечения смертность от ТЭЛА составляет около 30%, в первую очередь в связи с рецидивирующими эмболиями. Однако постановка диагноза с проведением эффективной терапии антикоагулянтами сопровождается снижением смертности до 2-8%. Хотя даже при своевременно установленном диагнозе спасти жизнь пациента удаётся не всегда, смертность в 4-6 раз выше в случаях, когда ТЭЛА нераспознана. Таким образом, быстрая и точная диагностика ТЭЛА поистине спасает жизнь.
Учитывая, что течение ТЭЛА, в том числе рецидивирование, непредсказуемо, каждый случай ТЭЛА необходимо рассматривать как серьёзную проблему. Даже небольшие тромбоэмболы являются маркерами существования скрытой опасности и могут быть предвестниками ТЭЛА в будущем. Чтобы подчеркнуть значимость тромбоэмболий без нарушения функции сердца и лёгких, предложен термин «сигнальная эмболия» [20].
- Гипокинез правого
Источник