Эпидемиология бронхиальной астмы в россии на 2015 год
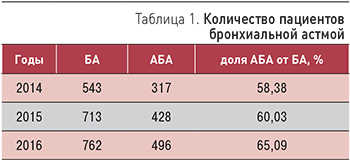
Цель исследования. Изучить распространенность, половозрастные особенности БА и ее атопической формы (АБА), выявить и проанализировать возможные их закономерности и тенденции на модели крупного многопрофильного учреждения первичной медико-санитарной помощи г. Москвы. Материалы и методы. Проведен анализ распространенности, половозрастных особенностей в структуре общей заболеваемости БА и АБА. Анализ заболеваемости проводили за 2014–2016 гг. Проведена статистическая обработка собранного материала и анализ полученных данных. Результаты. Отмечен рост распространенности БА и АБА. Абсолютное и относительное количество женщин, страдающих БА, стабильно больше, чем мужчин, а показатель распространенности при расчете на 1000 мужчин и 1000 женщин контингента выше среди пациентов мужского пола. БА встречается у пациентов всех возрастных групп. Выявлена тенденция к увеличению распространенности БА среди молодых пациентов и уменьшению среди лиц старческого возраста. Прослеживается четкая закономерность омоложения пациентов АБА. В будущем прогнозируется существенный рост распространенности БА в большей степени за счет атопической формы. Заключение. Полученные данные подтверждают продолжающийся рост заболеваемости БА преимущественно за счет АБА.
ВВЕДЕНИЕ
Всемирная организация здравоохранения (ВОЗ) считает бронхиальную астму (БА) одной из важнейших проблем общественного здоровья. Многие аналитики отмечают стойкую мировую тенденцию к нарастанию численности БА. Распространенность БА начала резко увеличиваться с 60-х гг. прошлого века в странах Западной Европы и Северной Америки, а спустя 20 лет и в странах Восточной Европы [1]. В 2011 г. уже 235 млн человек в мире страдало БА [2], в 2015 г. их количество достигло уже 358 млн [3], а к 2025 г., по мнению некоторых экспертов, это число может составить около 400–450 млн человек [1, 4]. На современном этапе тенденция по увеличению распространенности БА более выражена в развивающихся странах [5]. В странах с низким уровнем дохода населения наблюдается более высокий уровень смертности, связанный с БА [2].
В России также наблюдается тенденция к неуклонному росту распространенности БА. На это указывают и данные официальной статистики, и результаты эпидемиологических исследований отечественных ученых. Так, по информации Минздрава России, распространенность БА с 1991 по 1994 г. возросла на 32,3%, а с 1998 по 2002 г. – еще на 28,2% [6]. В последние годы также отмечен продолжающийся рост общей заболеваемости БА. С 2013 по 2014 г. общее количество зарегистрированных пациентов с БА в России увеличилось на 21 238 человек, в основном за счет пациентов Центрального и Южного федеральных округов [7]. В некоторых районах России только за последние 10 лет количество заболевших БА увеличилось в 1,6 раза [8]. Распространенность БА среди взрослого населения России составляет от 3,4 до 10,6%, [9, 10]. Согласно исследованиям GARD (Global Alliance against Respiratory Diseases – Глобальный альянс по борьбе с хроническими респираторными заболеваниями), распространенность симптомов БА значительно выше и составляет 25,7% [11]. В России смертность от БА составляет 2,3 на 100 000 населения [12]. По результатам исследования зарубежных авторов, этот показатель выше и составляет 6–10 случаев на 100 000 населения [1].
 Таким образом, изучение эпидемиологических особенностей БА на современном этапе представляет интерес как для организаторов здравоохранения, так и для практических врачей.
Таким образом, изучение эпидемиологических особенностей БА на современном этапе представляет интерес как для организаторов здравоохранения, так и для практических врачей.
Цель исследования. Изучить распространенность, половозрастные особенности БА и ее атопической формы (АБА), выявить и проанализировать возможные их закономерности и тенденции на модели крупного многопрофильного учреждения оказания первичной медико-санитарной помощи г. Москвы.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
На основе эпидемиологического наблюдательного описательно-оценочного (дескриптивного) исследования проведен анализ распространенности, половозрастных особенностей в структуре общей заболеваемости БА в целом и атопической ее формы (АБА) в частности. Эпидемиологическое исследование охватывает трехгодичный период (2014–2016). Собранный материал подвергался статистической …
Дина Владимировна Ушакова, врач аллерголог-иммунолог, зав. отделением аллергологии и иммунологии, пульмонологии и инфекционных заболеваний ФГБУ «Поликлиника № 1» УДП РФ. Адрес: 119002, Россия, Москва, пер. Сивцев Вражек, д. 26/28. Е-mail: d.ushakova@vipmed.ru
Евгений Леонидович Никонов, д.м.н., профессор, начальник управления делами и координации деятельности Департамента здравоохранения города Москвы. 127006, Россия, Москва, Оружейный пер., д. 43.
Источник
1. Global Initiative for Asthma. 2018 GINA Report, Global Strategy for Asthma Management and Prevention. Available at: https://ginasthma.org/2018-gina-report-global-strategy-for-asthma-management-and-prevention/ [Accessed June26, 2018].
2. Soriano J.B., Abajobir A.A., Abate K.H. et al. Global, regional, and national deaths, prevalence, disability-adjusted life years, and years lived with disability for chronic obstructive pulmonary disease and asthma, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet Respir. Med. 2017; 5 (9): 691–706. DOI: 10.1016/S2213-2600(17)30293-X.
3. Coté J., Cartier A., Robichaud P. et al. Influence on asthma morbidity of asthma education programs based on self-management plans following treatment optimization. Am. J. Respir. Crit. Care Med. 1997; 155 (5): 1509–1514. DOI: 10.1164/ajrccm.155.5.9154850.
4. Accordini S., Corsico A.G., Braggion M. et al. The cost of persistent asthma in Europe: an international population-based study in adults. Int. Arch. Allergy Immunol. 2013; 160 (1): 93–101. DOI: 10.1159/000338998.
5. Puig-Junoy J., Pascual-Argenté N. Socioeconomic costs of asthma in the European Union, United States and Canada: A systematic review. Rev. Esp. Salud. Publica. 2017; 91: pii: e201703025.
6. Winer R.A., Qin X., Harrington T. et al. Asthma incidence among children and adults: findings from the Behavioral Risk Factor Surveillance system asthma call-back survey – United States, 2006 – 2008. J. Asthma. 2012; 49 (1): 16–22. DOI: 10.3109/02770903.2011.637594.
7. Bousquet J., Mantzouranis E., Cruz A.A. et al. Uniform definition of asthma severity, control, and exacerbations: document presented for the World Health Organization Consultation on Severe Asthma. J. Allergy Clin. Immunol. 2010; 126 (5): 926–938. DOI: 10.1016/j.jaci.2010.07.019.
8. Chuchalin A.G., Khaltaev N., Antonov N.S. et al. Chronic respiratory diseases and risk factors in 12 regions of the Russian Federation. Int. J. Chron. Obstruct. Pulmon. Dis. 2014; 9 (1): 963–974. DOI: 10.2147/COPD.S67283.
9. Авксентьева М.В., Ильина Н.И., Лазарева Н. Б., Омельяновский В.В. Социально-экономическое бремя бронхиальной астмы и хронической обструктивной болезни легких в Российской Федерации. Отчет по исследованию за 2008–2009 годы. М.: Региональный благотворительный общественный фонд содействия деятельности в сфере пропаганды здорового образа жизни «Качество жизни»; 2010.
10. Чучалин А.Г., Архипов В.В., Астафьева Н.Г. и др. Национальная программа «Бронхиальная астма у детей. Стратегия лечения и профилактика». Москва: ОАО «Первая Образцовая типография»; 2012.
11. Ильина Н.И., Ненашева Н.М., Авдеев С.Н. и др. Алгоритм биофенотипирования и выбор таргетной терапии тяжелой неконтролируемой бронхиальной астмы с эозинофильным типом воспаления дыхательных путей. Российский аллергологический журнал. 2017; 14 (3): 5–18.
12. Министерство здравоохранения Российской Федерации. Статистическая информация Минздрава РФ. 2015. Доступно на: https://www.rosminzdrav.ru/documents/9479-statisticheskaya-informatsiya-za-2014 [Дата обращения 26.06.18].
13. GBD 2015 Chronic Respiratory Disease Collaborators. Global, regional, and national deaths, prevalence, disability-adjusted life years, and years lived with disability for chronic obstructive pulmonary disease and asthma, 1990 – 2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet Respir. Med. 2017; 5 (9): 691–706. DOI: 10.1016/S2213-2600(17)30293-X.
14. Global Initiative for Asthma. GINA Report 2011, Global Strategy for Asthma Management and Prevention. Available at: https://ginasthma.org/ [Accessed June 26, 2018].
15. Емельянов А.В., Сергеева Г.Р., Коровина О.В., Собченко СА. Современная терапия бронхиальной астмы. Российский семейный врач. 2012; 16 (2): 9–15.
16. Федосеев Г.Б., Трофимов В.И. Бронхиальная астма. СПб: Нордмедиздат; 2006.
17. Цой А.Н., Архипов В.В., Гавришина Е.В. Эффективность Симбикорта в реальной клинической практике: результаты Российского национального исследования. Пульмонология. 2006; (2): 60–66.
18. Архипов В.В., Григорьева Е.В., Гавришина Е.В. Контроль над бронхиальной астмой в России: результаты многоцентрового наблюдательного исследования НИКА. Пульмонология. 2011; (6): 87–93. DOI: 10.18093/0869-0189-2011-0-6-87-93.
19. Rabe K.F., Vermeire P.A., Soriano J.B., Maier W.C. Clinical management of asthma in 1999: the Asthma Insights and Reality in Europe (AIRE) study. Eur. Respir. J. 2000; 16 (5): 802–807. DOI: 10.1183/09031936.00.16580200.
20. Partridge M.R., van der Molen T., Myrseth S-E., Busse W.W. Attitudes and actions of asthma patients on regular maintenance therapy: the INSPIRE study. BMC Pulm. Med. 2006; 6: 13. DOI: 10.1186/1471-2466-6-13.
21. Chapman K.R., Boulet L.P., Rea R.M., Franssen E. Suboptimal asthma control: prevalence, detection and consequences in general practice. Eur. Respir. J. 2008; 31 (2): 320–325. DOI: 10.1183/09031936.00039707.
22. Ненашева Н.М. Биологическая терапия бронхиальной астмы: настоящее и будущее. Consilium medicum. 2016; 18 (11): 30–38.
23. рекомендации по диагностике и лечению бронхиальной астмы. M.: Российское респираторное общество; 2016. Доступно на: https://spulmo.ru/obshchestvo/news/news-812/ [Дата обращения 26.06.18].
24. Ненашева Н.М. Фенотипы бронхиальной астмы и выбор терапии. Практическая пульмонология. 2014; (2): 2–11.
25. Chung K.F, Wenzel S.E., Brozek J.L. et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur. Respir. J. 2014; 43 (2): 343–373. DOI: 10.1183/09031936.00202013.
26. Israel E., Reddel H.K. Severe and Difficult-to-Treat Asthma in Adults. N. Engl. J. Med. 2017; 377 (10): 965–976. DOI: 10.1056/NEJMra1608969.
27. Геренг Е.А., Суходоло И.В., Плешко Р.И. и др. Морфологические маркеры ремоделирования слизистой оболочки бронхов при тяжелой форме бронхиальной астмы и хронической обструктивной болезни легких. Пульмонология. 2009; (4): 64–68.
28. Емельянов АВ. Тяжелая бронхиальная астма. Астма и аллергия. 2013; (3): 16–18.
29. GfK. Изучение поведения врачей при лечении пациентов с бронхиальной астмой (БА) и хронической обструктивной болезнью легких (ХОБЛ). 2018. Доступно на: https://www.gfk.com/fileadmin/user_upload/dyna_content/RU/Documents/News/2015/Out-patient-treatment-of-bronchial-asthma-current-clinical-practice-review.doc [Дата обращения 26.06.18].
30. Харитонс М.А., Рамазанова К.А. Современные представления о лечении бронхиальной астмы. Терра Медика Нова. 2001; (1). Доступно на: https://medi.ru/info/6513/ [Дата обращения 26.06.18].
31. Астафьева Н.Г., Гамова И.В., Удовиченко Е.Н. и др. Клинические фенотипы бронхиальной астмы у подростков: трудности диагностики и терапии. Лечащий врач. 2015; (4): 20.
32. Куличенко Т.В. Омализумаб у детей с бронхиальной астмой: показания к применению. Педиатрическая фармакология. 2007; 4 (6): 51–55.
33. Fuhlbrigge A., Reed M.L., Stempel D.A. The status of asthma control in the U.S. adult population. Allergy Asthma Proc. 2009; 30 (5): 529–533. DOI: 10.2500/aap.2009.30.3276
34. Demoly P., Annunziata K., Gubba E., Adamek L. Repeated cross-sectional survey of patient-reported asthma control in Europe in the past 5 years. Eur. Respir. Rev. 2012; 21 (123): 66–74. DOI: 10.1183/09059180.00008111.
35. Reddel H.K., Sawyer S.M., Everett P.W. et al. Asthma control in Australia: a cross-sectional web-based survey in a nationally representative population. Med. J. Aust. 2015; 202 (9): 492–497. DOI: 10.5694/mja14.01564.
36. Olaguibel J.M., Quirce S., Juliá B. et. al. Measurement of asthma control according to Global Initiative for Asthma guidelines: a comparison with the Asthma Control Questionnaire. Respir. Res. 2012; 13: 50. DOI: 10.1186/1465-9921-13-50.
37. Hekking P.-P.W., Wener R.R., Amelink M. et al. The prevalence of severe refractory asthma. J. Allergy Clin. Immunol. 2015; 135 (4): 896–902. DOI: 10.1016/j.jaci.2014.08.042.
38. Чучалин А.Г., Огородова Л.М., Петровский Ф.И. и др. Базисная терапия бронхиальной астмы у взрослых. Данные национального исследования НАБАТ. Пульмонология. 2004; (6): 68–77.
39. Ильина Н.И. Бронхиальная астма: современные возможности контроля. Эффективная фармакотерапия. 2014; 33: 28–29. Доступно на: https://umedp.ru/upload/iblock/7e2/7e23b1427f097b02e9fe530d442ce94a.pdf [Дата обращения 26.06.18].
40. Сергеева Г.Р., Емельянов А.В., Коровина О.В. и др. Тяжелая бронхиальная астма: характеристика пациентов в клинической практике. Терапевтический архив. 2015; 87 (12): 26–31. DOI: 10.17116/terarkh2015871226-31.
41. Novelli F., Latorre M., Vergura L. et. al. Asthma control in severe asthmatics under treatment with omalizumab: a cross-sectional observational study in Italy. Pulm. Pharmacol. Ther. 2015; 31: 123–129. DOI: 10.1016/j.pupt.2014.09.007.
42. Bateman E.D., Reddel H.K., Eriksson G. et al. Overall asthma control: the relationship between current control and future risk. J. Allergy Clin. Immunol. 2010; 125 (3): 600–608. DOI: 10.1016/j.jaci.2009.11.033.
43. Ненашева Н.М. Омализумаб в терапии тяжелой бронхиальной астмы. Эффективная фармакотерапия. 2014; (29): 24–35.
44. Wenzel S. Severe asthma: from characteristics to phenotypes to endotypes. Clin. Exp. Allergy. 2012; 42 (5): 650–658. DOI: 10.1111/j.1365-2222.2011.03929.x.
45. Федосеев Г.Б., Трофимов В.И., Шапорова Н.Л. и др. В поисках истины: что такое бронхиальная астма? Пульмонология. 2015; 25 (1): 5–18. DOI: 10.18093/0869-0189-2015-25-1-5-18.
46. Boudier A., Curjuric I., Basagaña X. et al. Ten-year follow-up of cluster-based asthma phenotypes in adults. A pooled analysis of three cohorts. Am. J. Respir. Crit. Care Med. 2013; 188 (5): 550–560. DOI: 10.1164/rccm.201301-0156OC.
47. Hancox R.J., Cowan D.C., Aldridge R.E. et al. Asthma phenotypes: consistency of classification using induced sputum. Respirology. 2012; 17 (3): 461–466. DOI: 10.1111/j.1440-1843.2011.02113.x.
48. Anderson G.P. Endotyping asthma: new insights into key pathogenic mechanisms in a complex, heterogeneous disease. Lancet. 2008; 372 (9643): 1107–1019. DOI: 10.1016/S0140-6736(08)61452-X.
49. Chung K.F. Asthma phenotyping: a necessity for improved therapeutic precision and new targeted therapies. J. Intern. Med. 2016; 279 (2): 192–204. DOI: 10.1111/joim.12382.
50. Fahy J.V. Type 2 inflammation in asthma – present in most, absent in many. Nat. Rev. Immunol. 2015; 15 (1): 57–65. DOI: 10.1038/nri3786.
51. Schleich F., Brusselle G., Louis R. et. al. Heterogeneity of phenotypes in severe asthmatics. The Belgian Severe Asthma Registry (BSAR). Respir. Med. 2014; 108 (12): 1723–1732. DOI: 10.1016/j.rmed.2014.10.007.
52. Simpson J.L., Scott R., Boyle M.J., Gibson P.G. Inflammatory subtypes in asthma: assessment and identification using induced sputum. Respirology. 2006; 11 (1): 54–61. DOI: 10.1111/j.1440-1843.2006.00784.x.
53. Курбачева О.М., Павлова К.С. Фенотипы и эндотипы бронхиальной астмы: от патогенеза и клинической картины к выбору терапии. Российский аллергологический журнал. 2013; (1): 15–24.
54. Фассахов Р.С. Современная фармакотерапия бронхиальной астмы: приоритеты в достижении контроля вне зависимости от степени тяжести. Русский медицинский журнал. 2017; 25 (3): 221–226.
55. de Groot J.C., Ten Brinke A., Bel E.H.D. Management of the patient with eosinophilic asthma: a new era begins. Eur. Res. J. Open Res. 2015; 1 (1): pii: 00024-2015. DOI: 10.1183/23120541.00024-2015.
56. Miranda C., Busacker A., Balzar S. et al. Distinguishing severe asthma phenotypes: role of age at onset and eosinophilic inflammation. J. Allergy Clin. Immunol. 2004; 113 (1): 101–108. DOI: 10.1016/j.jaci.2003.10.041.
57. Haldar P., Pavord I.D., Shaw D.E. et al. Cluster analysis and clinical asthma phenotypes. Am. J. Respir. Crit. Care Med. 2008; 178 (3): 218–224. DOI: 10.1164/rccm.200711-1754OC.
58. Nair P., Pizzichini M.M., Kjarsgaard M. et al. Mepolizumab for prednisone-dependent asthma with sputum eosinophilia. N. Engl. J. Med. 2009; 360 (10): 985–993. DOI: 10.1056/NEJMoa0805435.
59. van Veen I.H., Ten Brinke A., Gauw S.A. et. al. Consistency of sputum eosinophilia in difficult-to-treat asthma: a 5-year follow-up study. J. Allergy Clin. Immunol. 2009; 124 (3): 615–617. DOI: 10.1016/j.jaci.2009.06.029.
60. Ненашева Н.М., Авдеев С.Н., Емельянов А.В. и др. Реслизумаб в лечении больных тяжелой бронхиальной астмой эозинофильного фенотип. Пульмонология. 2017; 27 (4): 515–528. DOI: 10.18093/0869-0189-2017-27-4-515-528.
61. Cisneros Serrano C., Melero Moreno C., Almonacid Sánchez C. et al. Guidelines for Severe Uncontrolled Asthma. Arch. Bronconeumol. (Engl. Ed.) 2015; 51 (5): 235–246. DOI: 10.1016/j.arbres.2014.12.007.
62. Wenzel S. Severe asthma in adults. Am. J. Respir. Crit. Care Med. 2005; 172 (2): 149–160. DOI: 10.1164/rccm.200409-1181PP.
63. de Groot J.C., Storm H., Amelink M. et al. Clinical profile of patients with adult-onset eosinophilic asthma. Eur. Res. J. Open Res. 2016; 2 (2): 00100-2015. DOI: 10.1183/23120541.00100-2015.
64. ten Brinke A., de Lange C., Zwinderman A.H. et al. Sputum induction in severe asthma by a standardized protocol: predictors of excessive bronchoconstriction. Am. J. Respir. Crit. Care Med. 2001; 164 (5): 749–753. DOI: 10.1164/ajrccm.164.5.2009035.
65. Pin I., Gibson P.G., Kolendowicz R. et al. Use of induced sputum cell counts to investigate airway inflammation in asthma. Thorax. 1992; 47 (1): 25–29. DOI: 10.1136/thx.47.1.25.
66. Buhl R., Humbert M., Bjermer L. et al. Severe eosinophilic asthma: a roadmap to consensus. Eur. Respir. J. 2017; 49 (5): 1700634. DOI: 10.1183/13993003.00634-2017.
67. Korevaar D.A., Westerhof G.A., Wang J. et al. Diagnostic accuracy of minimally invasive markers for detection of airway eosinophilia in asthma: a systematic review and meta-analysis. Lancet Respir. Med. 2015; 3 (4): 290–300. DOI: 10.1016/S2213-2600(15)00050-8.
68. Westerhof G.A., Korevaar D.A., Amelink M. et al. Biomarkers to identify sputum eosinophilia in different adult asthma phenotypes. Eur. Respir. J. 2015; 46 (3): 688–696. DOI: 10.1183/09031936.00012415.
69. Katz L.E., Gleich G.J., Hartley B.F. et.al. Blood eosinophil count is a useful biomarker to identify patients with severe eosinophilic asthma. Ann. Am. Thorac. Soc. 2014; 11 (4):531–536. DOI: 10.1513/AnnalsATS.201310-354OC.
70. Zhang X.Y., Simpson J.L., Powell H. et al. Full blood count parameters for the detection of asthma inflammatory phenotypes. Clin. Exp. Allergy. 2014; 44 (9): 1137–1145. DOI: 10.1111/cea.12345.
71. Green R.H., Brightling C.E., McKenna S. et al. Asthma exacerbations and sputum eosinophil counts: a randomised controlled trial. Lancet. 2002; 360 (9347): 1715–1721. DOI: 10.1016/S0140-6736(02)11679-5.
72. Schleich F.N., Chevremont A., Paulus V. et al. Importance of concomitant local and systemic eosinophilia in uncontrolled asthma. Eur. Respir. J. 2014; 44 (1): 97–108. DOI: 10.1183/09031936.00118014.
73. Bleecker E.R., FitzGerald J.M., Chanez P. et al. Efficacy and safety of benralizumab for patients with severe asthma uncontrolled with high-dosage inhaled corticosteroids and long-acting β2-agonists (SIROCCO): a randomised, multicentre, placebo-controlled phase 3 trial. Lancet. 2016; 388 (10056): 2115–2127. DOI: 10.1016/S0140-6736(16)31324-1.
74. Marks and Spencer Decisions LLC. The report on search and selection of relevant original publications on prevalence, morbidity, phenotype, severity rate, control level and other key characteristics of bronchial asthma. Moscow; 2017.
75. de Carvalho-Pinto R.M., Cukier A., Angelini L. et al. Clinical characteristics and possible phenotypes of an adult severe asthma population. Respir. Med. 2012; 106 (1): 47–56. DOI: 10.1016/j.rmed.2011.08.013.
76. Barnes P.J. Intrinsic asthma: not so different from allergic asthma but driven by superantigens? Clin. Exp. Allergy. 2009; 39 (8): 1145–1151. DOI: 10.1111/j.1365-2222.2009.03298.x.
77. Yoo H.S., Shin Y.S., Liu J.N. et al. Clinical significance of immunoglobulin E responses to staphylococcal superantigens in patients with aspirin-exacerbated respiratory disease. Int. Arch. Allergy Immunol. 2013; 162 (4): 340–345. DOI: 10.1159/000353976.
78. Zervas E., Samitas K., Papaioannou A.I. et al. An algorithmic approach for the treatment of severe uncontrolled asthma. Eur. Res. J. Open Res. 2018; 4 (1): pii: 00125-2017. DOI: 10.1183/23120541.00125-2017.
79. Song W.J., Jo E.J., Lee J.W. et al. Staphylococcal enterotoxin specific IgE and asthma: a systematic review and meta-analysis. Asia Pac. Allergy. 2013; 3 (2): 120–126. DOI: 10.5415/apallergy.2013.3.2.120.
80. Zureik M., Neukirch C., Leynaert B. et al. Sensitisation to airborne moulds and severity of asthma: cross sectional study from European Community respiratory health survey. Br. Med. J. 2002; 325 (7361): 411–414.
81. Chipps B.E., Newbold P., Hirsch I. et al. Benralizumab efficacy by atopy status and serum immunoglobulin E for patients with severe, uncontrolled asthma. Ann. Allergy Asthma Immunol. 2018; 120 (5): 504–511. DOI: 10.1016/j.anai.2018.01.030.
82. Jarvis D., Newson R., Lotvall J. et al. Asthma in adults and its association with chronic rhinosinusitis: the GA2LEN survey in Europe. Allergy. 2012; 67 (1): 91–98. DOI: 10.1111/j.1398-9995.2011.02709.x.
83. Fokkens W.J., Lund V.J., Mullol J. et al. European position paper on rhinosinusitis and nasal polyps 2012. Rhinol. Suppl. 2012; 23: 1–298.
84. Костина Е.М., Молотилов Б.А. Комбинированный метод терапии бронхиальной астмы в сочетании с полипозом носа. Практическая медицина. 2016; 3 (95): 39–44.
85. Agache I., Akdis C., Jutel M., Virchow J.C. Untangling asthma phenotypes and endotypes. Allergy. 2012; 67 (7): 835–846. DOI: 10.1111/j.1398-9995.2012.02832.x.
86. Szczeklik A., Stevenson D.D. Aspirin-induced asthma: advances in pathogenesis, diagnosis, and management. J. Allergy Clin. Immunol. 2003; 111 (5): 913–921. DOI: 10.1067/mai.2003.1487.
87. Dusser D., Montani D., Chanez P. et al. Mild asthma: an expert review on epidemiology, clinical characteristics and treatment recommendations. Allergy. 2007; 62 (6): 591–604. DOI: 10.1111/j.1398-9995.2007.01394.x.
88. Price D., Fletcher M., van der Molen T. Asthma control and management in 8,000 European patients: the REcognise Asthma and LInk to Symptoms and Experience (REALISE) survey. NPJ Prim. Care Respir. Med. 2014; 24: 14009. DOI: 10.1038/npjpcrm.2014.9.
89. Bobolea I.D., Melero C., Jurado-Palomo J. Current and future asthma treatments: phenotypical approach on the path to personalized medicine in asthma. In: Pereira C., ed. Asthma. From CHILDHOOD ASTHMA to ACOS Phenotypes. London: Intech Open; 2016: 115–135. DOI: 10.5772/62411.
90. Колбин А.С., Фролов М.Ю., Галанкин Т.Л. Фармакоэкономический анализ лечения больных тяжелой неконтролируемой бронхиальной астмой в России. Практическая пульмонология. 2015; (4): 10–17.
91. Рудакова А.В. Фармакоэкономические аспекты поддерживающей терапии бронхиальной астмы ингаляционными кортикостероидами. Качественная клиническая практика. 2013; (1): 47–49.
92. Walker S., Monteil M., Phelan K. et al. Anti-IgE for chronic asthma in adults and children. Cochrane Database Syst. Rev. 2006; (2): CD003559. DOI: 10.1002/14651858.CD003559.pub3.
93. Rodrigo G.J., Neffen H., Castro-Rodriguez J.A. Efficacy and safety of subcutaneous omalizumab vs placebo as add-on therapy to corticosteroids for children and adults with asthma: a systematic review. Chest. 2011; 139 (1): 28–35. DOI: 10.1378/chest.10-1194.
94. Bousquet J., Rabe K., Humbert M. et al. Predicting and evaluating response to omalizumab in patients with severe allergic asthma. Respir. Med. 2007; 101 (7): 1483–1492. DOI: 10.1016/j.rmed.2007.01.011.
95. Hanania N.A., Alpan O., Hamilos D.L. et al. Omalizumab in severe allergic asthma inadequately controlled with standard therapy: a randomized trial. Ann. Intern. Med. 2011; 154 (9): 573–582. DOI: 10.7326/0003-4819-154-9-201105030-00002.
96. Braunstahl G.J., Chlumský J., Peachey G., Chen C.W. Reduction in oral corticosteroid use in patients receiving omalizumab for allergic asthma in the real-world setting. Allergy Asthma Clin. Immunol. 2013; 9 (1): 47. DOI: 10.1186/1710-1492-9-47.
Источник

