Контроль эффективности лечения при бронхиальной астме

Препараты
для
контроля
за течением БА назначают
всем больным, кроме пациентов
с очень легким течением БА (несколько
приступов в год). При этом предпочтение
отдают ЛС с противовоспалительным
эффектом — глкжо-кортикостероидам.
У больных с легким
течением БА целесообразно использовать
стабилизаторы мембран тучных клеток
или низкие дозы ингаляционных
глюкокортико-стероидов. более тяжелое
течение заболевания предусматривает
применение средних и высоких доз
ингаляционных глюкокортикостероидов
в сочетании с
р2-адреностимуляторами
длительного действия. Если на фоне
приема высоких доз ингаляционных
глюкокортикостероидов сохраняются
приступы удушья и остается высокая
потребность в применении симптоматических
средств, наряду с ингаляционными
глюкокортикостероидами и
р,-адрепостимуляторами длительного
действия назначают препараты теофиллина
пролонгированного действия, модификаторы
лейкотриенов, а при наиболее тяжелых
формах БА — глюкокортикостероиды дают
внутрь.
При особом варианте
течения БА — сочетании астмы с полипозом
носа и непереносимостью НПВС
(так называемая
аспириновая астма) — терапию ингаляционными
глкжокортикостероидами можно дополнить
ингибиторами лейкотриенов.
Одновременно
с проведением базовой терапии для
купирования
симптомов БА
больным назначают Р2-адреностимуляторы
короткого действия в режиме «по
требованию».
При
лечении обострений БА (в
условиях скорой медицинской помощи и
в стационаре)
применяют ингаляции р;-адреностимуляторов
короткого действия, м-холиноблокаторы
(в сочетании с Р2-адреностимуляторами),
инъекции эуфил-лина. Тяжелое обострение
БА является показанием к назначению
короткого (10—14 дней) курса лечения
глюкокортикостеро идам и внутрь
(преднизолон 40-60 мг/сут).
Тяжелая
бронхообструкция может потребовать
ингаляций кислорода.
Целью лечения БА
является достижение контроля за течением
заболевания:
исчезновение у
больного симптомов и жалоб;
исчезновение
признаков бронхообструкции при
проведении спирометрии;
290 ■*
Клиническая фармакология и фармакотерапия
•*■ Глава 19
уменьшение
числа обострений и увеличение промежутков
времени 6cj
всех
проявлений ЬА;
повышение
качества жизни больного и его способности
выполнять физические
нагрузки.
Контроль
38 течением заболевания подрапмевает
минимальную выраженность или полное
отсутствие всех симптомов заболевайия.
отсутствие симптомов
ЬА в ночные часы, стабильную пиковую
скорость выдоха (не менее 80% должного)
и минимальную потребность в
р.-алреностимуляторах короткого
действия.
Эффективность
различных Л С. применяемых при лечении
БА, оценивается в
различные промежутки времени. Так,
‘_к|х|>екгивность ингаляционных
брон-холитиков
для лечения приступов ЬА можно оценить
уже через 15 30 чин после их применения
по увеличению показателей спиромефии.
Эффективность глюкокортикостероилов
можно оценить только через 1-7 сут. а
интата и тайле-да
— не ранее чем через 1 мес после начата
лечения. Важными критериями эффективности
лечения глюкокортикостероидачн являются
исчезновение приступов
в ночные часы и уменьшение суточной
потребности в (З.-адреностимуля-торах.
19.2. Хронические обструктивные болезни легких
ХОЬЛ
включают в себя ряд хронических болезней
дыхательной системы с необратимым
и прогрессирующим снижением возлушного
потока. Причиной нарушения
дыхания при ХОВЛ являются хроническое
воспаление бронхиальной стенки, ее
ремоделирование и славление извне
вследствие эмфиземы и пневчосклероза.
К ХОБЛ относят хронический обструктивный
бронхит, эмфизему
легких, бронхозктатическую болезнь.
Этнология
и патогенез. К ХОБЛ приводит длительное
воздействие на бронхиальную
стенку различных повреждающих факторов,
таких, как табачный дым,
врелные факторы производственной среды
(цементная, мучная, бумажная
или хлопковая пыль, горячим сухой возлуч
в металлуртичееких пехах) или частые
инфекции нижних дыхательных путей.
Определенную роль играют наследственные
факторы, связанные со снижением
резистентности организма (недостаток
о^-антитрипсина). Длительное воздействие
повреждающих факторов
на эпителий дыхательных путей приводит
к развитию длительного хронического
воспатсния с бронхообструкпией. При
ХОБЛ бронхообструкпия преимущественно
необратимая, поэтому все лечебные
мероприятия направлены
на профилактику дальнейшего
прогрессировапия заболевания и
уменьшение
выраженности отдельных симптомов. ХОБЛ
свойственны многолетнее.
мехтенно прогрессирующее течение,
частые обострения, обычно связанные с
инфекцией нижних дыхательных путей и
приводящие к инвалидизаиии больных
из-за развития тяжелой дыхательной
недостаточности. Несмотря на то что
ХОБЛ обычно развивается уже в зрелом
возрасте (посте 40 -45 лег). общая
продолжительность
жизни значительно сокращается.
Эпидемиология.
ХОБЛ является самым распространенным
хроническим заболеванием
органов дыхания и лидирует по числу
лней нетрудоспособности
Заболевания
легких и бронхов ♦ 291
и причинам
инвалидности. ХОБЛ занимают 4-е место
среди причин счерш взрослого населения.
В нашей стране около 10 млн больных ХОЬЛ.
Симитомокомплекс
ХОБЛ. ХОБЛ
возникают, как правило, у лип старше 45
лет. срели больных преобладаю! мужчины.
Основными симптомами заболевания
яатяются ежедневный кашель с отделением
мокрош. одышка (сначала при физической
нагрузке, а при дальнейшем протрессировании
заболевания и в покое). Протрессирование
бронх(юбструкиии сопровождается
увеличением частоты
дыхания (удлиняется (раза вылоха) и
развшием ортопно)1.
При тяжелой дыхательной недостаточности
кожа больных приобретает сероватый
оттенок (цианоз) из-за
снижения концентрации кислорода в
крови. Дальнейшее нарастание гипоксии
привода к нарушению сознания, возможна
остановка дыхания.
У больных с тяжелыми
ХОБЛ повышение даатения в легочной
артерии приводит к гипертрофии и
дилатаиии правых отделов сердиа. С
течением времени иро1рессирует
снижение сократимости правого желудочка,
формируется 1ак называемое хроническое
легочное сердце, развивается застой
крови в большом круге кровообращения
(увеличение печени, отеки, асцит).
Течение
и тяжесть заболевания. ХОБЛ
свойственно постепенное прогресси-рование.
Обострения
связаны с инфекцией нижних дыхательных
пугей:.
При этом увеличивается количество
отделяемой мокроты, которая становится
гнойной. повышается температура
тела, нарастают одышка и кашель.
Тяжесть заболевания
определяется по уровню нарушения
бронхиальной проходимости. У пациентов
группы риска нарушений бронхиальной
проходимости нет, но отмечается
длительный продуктивный кашель. При
легком течении объем фиксированного
выдоха за 1-ю секунду составляет 80%
должного. Наиболее типичным симптомом
является кашель. При умеренном течении
объем фиксированного вылоха равен 80
50*? должного. Больной отмечает кашель
и одышку при небольшой физической
нагрузке. При тяжелом течении ХОБЛ
объем фиксированного выдоха менее 505Б
должного. Отмечаются выраженная
одышка (в том числе и в покое) и кашель.
Методы
обследования и лиагаостика. К наиболее
информативным методам обследования
больных ХОБЛ относятся:
Источник

С 1970-х годов распространенность бронхиальной астмы (БА) увеличивалась в большинстве стран мира, что связано с урбанизацией и переориентацией образа жизни на западный.
John Rees, Лондон, Великобритания
На сегодня в мире около 300 млн больных БА (рис. 1); по прогнозам, в 2025 г. этот показатель может составить 400 млн. Бронхиальная астма ответственна за каждую 250-ю смерть и составляет 1% от всех причин нетрудоспособности. Среди пациентов
в возрасте от 18 до 64 лет хронические симптомы БА являются причиной неудовлетворительного самочувствия в 8% случаев. Хорошо контролированная астма уменьшает бремя хронической паталогии как для пациентов, так и для служб здравоохранения.
Контроль БА означает минимум симптомов и отсутствие обострений –
для пациентов, удовлетворительные результаты клинико-инструментального обследования – для врачей, достижение конечных точек – в клинических исследованиях.
Контроль обычно определяется тяжестью симптомов, эффективной профилактикой обострений, а также с помощью простых исследований, таких как пикфлоуметрия. Современные руководства по бронхиальной астме утверждают,
что большинство пациентов с БА могут достигать полного контроля БА и вести нормальный образ жизни, который не ограничивают ни симптомы БА,
ни побочные эффекты терапии. Глобальная инициатива по астме (GINA) заявляет: «Астму можно успешно лечить и контролировать. У большинства пациентов можно предотвратить причиняющие беспокойство дневные и ночные симптомы и тяжелые приступы астмы; исключить или минимизировать применение скоропомощных препаратов; достичь практически нормальной легочной функции; сохранить активный образ жизни».
Хороший контроль БА позволяет получить как краткосрочные, так и отдаленные выгоды
— Способ достижения контроля БА должен учитывать собственные цели и ожидания пациента
— Индивидуализированное лечение, основанное на подавлении воспаления дыхательных путей, может дать лучшие результаты при меньшей терапевтической нагрузке
— Необходимы дальнейшие исследования для поиска оптимального способа применения данного подхода и возможностей его внедрения в реальную клиническую практику
— При БА не следует применять длительно действующие β2-агонисты без ингаляционных кортикостероидов
— Для разных пациентов могут подходить различные способы лечения и контроля, однако простые индивидуализированные схемы терапии улучшают контроль
В руководствах GINA для определения тяжести БА используют также симптомы астмы (таблица), но при этом подчеркивается, что критерии адекватного контроля для каждого пациента зависят от его личных целей и ожиданий.
Определение фиксированного уровня легочной функции или целевого контроля симптомов неприемлемо, так как каждый пациент имеет свои цели и желает компромисса между этими целями, побочными эффектами или неудобством терапии, необходимой для достижения идеального контроля.
Достигнут ли хороший контроль?
Хотя в многочисленных клинических исследованиях показано, что хороший контроль БА может быть достигнут у большинства пациентов, это не соответствует реальной ситуации в общемировой популяции. В недавнем европейском исследовании 82% пациентов сообщили о недостаточном контроле БА, большинство из них вели ограниченный образ жизни. Хотя 94% пациентов сообщили, что хотели бы жить без симптомов астмы, 90% считают симптомы неотъемлемой ее частью. Исследование в США, охватившее около 60 тыс больных БА, показало, что недостаточный контроль БА был у 75%, у еще большего количества больных страдал образ жизни. Таким образом, хотя хороший контроль БА возможен и пациенты предпочитают не иметь симптомов астмы, достичь этого пока не удалось, возможно, отчасти из-за низких ожиданий пациентов и врачей.
Как измерить контроль?
Регулярное проведение пикфлоуметрии обеспечивает простую объективную оценку обструкции дыхательных путей, в то же время данное исследование может улучшить результаты лечения БА только в комбинации с мониторингом симптомов по индивидуализированному плану. Ценность пикфлоуметрии возрастает у пациентов с низкой чувствительностью к респираторной обструкции.
В клинической практике важно спрашивать пациента о контроле симптомов и влиянии БА на повседневную активность, чтобы лучше понять ощущение им контроля БА и отношение к заболеванию. Тем не менее существующие руководства часто не содержат адекватной информации для определения контроля БА. Для стандартизации подхода к оценке контроля симптомов были разработаны различные опросники. Королевская коллегия терапевтов (Великобритания) особо выделяет три вопроса, рекомендованные Британским торакальным обществом в качестве инструмента для опроса пациентов. Эти вопросы обеспечивают простой мониторинг, несмотря на некоторую необъективность.
Вопросы для оценки контроля астмы на протяжении прошлой недели или месяца
— Отмечали ли Вы расстройства сна из-за симптомов астмы (в том числе кашля)?
— Отмечали ли Вы обычные симптомы астмы в дневное время (кашель, одышку, тяжесть в груди или удушье)?
— Влияет ли астма на Вашу нормальную активность (например, работу по дому, профессиональную деятельность, учебу в школе)?
В клинических исследованиях для определения контроля астмы применяют более сложную оценку качества жизни. При этом учитывают симптомы, эмоциональную сферу, подверженность внешним стимулам, ограничение активности, участие в дыхании вспомогательных мышц и др. Один из возможных критериев астмы в клинических исследованиях – так называемые дни (недели) без астмы.
Контроль воспаления дыхательных путей
Даже если астма представляется контролированной, в биоптатах слизистой бронхов можно увидеть распространенное воспаление, на которое можно воздействовать лечением. Реальная оценка воспаления может позволить проводить терапию в соответствии с концепцией контроля патологического процесса. Этот подход требует простой, не требующей больших материальных затрат периодической оценки воспаления. Сюда входят следующие методы, которые позволяют уменьшить и частоту обострений, и терапевтическую нагрузку: бронхиальная биопсия или лаваж с последующим гистологическим исследованием; реактивность дыхательных путей; определение эозинофилии мокроты. Исследование выдыхаемого воздуха, в том числе мониторинг оксида азота (рис. 2), – более простой и перспективный метод, позволяющий снизить терапевтическую нагрузку без ухудшения контроля (рис. 3).
Преимущества эффективного длительного контроля БА
Контроль симптомов обеспечивает краткосрочные преимущества для пациентов, в то время как подавление воспаления уменьшает симптомы, обострения и необходимость в дополнительном лечении. Предполагают, что длительный контроль воспаления дыхательных путей может уменьшить вероятность их ремоделирования с прогрессией от обратимой обструкции до необратимой. Доказательств такой возможности появляется все больше, однако они косвенны и требуют длительных контролированных исследований. Обсервационные наблюдения показывают, что результатом отсроченного назначения противовоспалительной терапии может быть более низкая легочная функция.
Какие препараты использовать для контроля?
Фармакотерапия необходима большинству пациентов с бронхиальной астмой для контроля заболевания. Обычно у взрослых пациентов с БА наиболее эффективны ингаляционные кортикостероиды, они остаются базисными препаратами в постоянной терапии хронической астмы. Антагонисты лейкотриеновых рецепторов могут быть полезной альтернативой у пациентов, которые не могут или не хотят применять ингаляционные кортикостероиды; кроме того, препараты этой группы проявляют аддитивный эффект к низким или средним дозам ингаляционных кортикостероидов. В качестве альтернативных препаратов рассматривают также ингибиторы фосфодиэстеразы-4. Длительно действующие β2-агонисты обычно используют как дополнительную терапию выбора у пациентов, которые не достигают контроля на низких или средних дозах ингаляционных кортикостероидов.
Терапевтические стратегии
И ингаляционные кортикостероиды, и длительно действующие
β2-агонисты обычно применяют два раза в день. Поэтому эти препараты целесообразно комбинировать в ингаляторе, что к тому же исключает применение только длительно действующих β2-агонистов. Выделяют два подхода к контролю симптомов БА.
• Назначение доз, достаточных для полного подавления симптомов, предполагая длительный стабильный контроль. В клинических исследованиях этот подход характеризовался получением оптимального контроля БА у 71% пациентов.
• Изменение доз в ответ на изменение симптомов, что используют много пациентов. В этом случае удвоения дозы ингаляционных кортикостероидов может быть недостаточно. В ряде исследований при нарушении контроля дозу повышали в 4 раза с быстрым снижением после исчезновения симптомов. Данный подход, вовлекающий пациента в более активный терапевтический план, только в некоторых исследованиях позволил достичь лучшего контроля с более редкими обострениями и с меньшей дозой ингаляционных кортикостероидов, при этом увеличение дозы проводили после изменения симптомов на протяжении 24-48 часов.
Один из указанных двух подходов может быть рекомендован для пациентов, которые хотят либо активно контролировать свое заболевание и минимизировать терапию, либо полностью подавлять симптомы астмы с изменением терапии только при обострениях. Другие подходы сегодня считают неэффективными для контроля БА.
Предикторы низкой приверженности терапии БА
Факторы, на которые трудно или невозможно влиять
— Психологические проблемы
— Когнитивные расстройства
— Бессимптомное заболевание
— Длительность заболевания
— Стоимость лечения
Пациент
— Пропуск доз
Врач и пациент
— Неадекватное ведение или планирование визитов
— Побочные эффекты препаратов или беспокойство о таких эффектах
— Недостаточная вера в терапию
— Непонимание сути заболевания
— Плохие взаимоотношения пациента с медицинским персоналом
— Препятствия уходу и лечению
— Сложность терапии
Приверженность терапии
В последнее десятилетие значительное внимание уделяется соблюдению режима терапии. При достижении удовлетворительного контроля симптомы перестают действовать как напоминающий фактор. На приверженность лечению влияет много факторов:
• Терапевтические цели пациента
• Вера пациента в терапию
• Социально-экономические факторы
• Путь введения препаратов
• Выбранное устройство для введения
• Отношение к побочным эффектам
Для согласования терапевтической стратегии врачу следует принимать во внимание ожидания пациента от лечения бронхиальной астмы. На практике пациенты могут выявлять различные шаблоны приверженности. Особое значение приверженность имеет у пациентов, получающих монотерапию ингаляционными кортикостероидами, так как после применения препарата немедленного облегчения не наступает. Перспективным считают индивидуальную бихевиоральную терапию. Более доступный метод – регулярно проверять ингаляционные устройства.
Ведущие руководства подчеркивают важность следования адекватному плану ведения пациентов с БА для достижения контроля над заболеванием. Прогноз улучшают обучение пациентов, профилактические осмотры, ведение пациентом письменного терапевтического дневника. Наиболее важные составляющие плана ведения – индивидуализация и простота для пациента.
Дальнейшее улучшение мониторинга пациентов с БА зависит от новейших технологических разработок, таких как портативный цифровой пикфлоуметр, использование коммуникационных средств для интерактивного ведения пациентов, интеллектуальные ингаляторы с функцией напоминания и регистрации принятых доз.
Статья подготовлена по материалам British Medical Journal, 2006; 332:767-771.
Подготовил Алексей Гладкий
1001 причина говорить об аллергии и инфекциях вместе
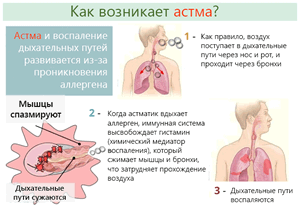
Бронхиальная астма – одно из самых широко распространенных хронических заболеваний, которое при отсутствии адекватного лечения приводит к существенному ухудшению качества жизни, а в ряде случаев – и к летальному исходу. К сожалению, уровень заболеваемости БА в большинстве стран мира неуклонно растет, в особенности среди детей. По оценкам экспертов Глобальной инициативы по борьбе с бронхиальной астмой (GINA), приведенным в недавно опубликованной «Глобальной стратегии по лечению и профилактике бронхиальной астмы» (пересмотр 2006 г.), в настоящее время в мире этим заболеванием страдает около 300 млн человек! В разных регионах мира распространенность БА в популяции колеблется от 1 до 18%.
В основе патогенеза аллергических заболеваний, в том числе и БА, лежит генетическая предрасположенность к аномально повышенному иммунному ответу на воздействие широкого спектра факторов окружающей среды – аллергенов. При его реализации возникает хроническое аллергическое воспаление, которое локализуется в определенном «органе-мишени»: коже при атопическом дерматите, слизистой оболочке кишечника при пищевой аллергии и, наконец, слизистой оболочке бронхов при БА, представляющей собой не что иное, как хроническое аллергическое воспалительное заболевание дыхательных путей. К наиболее распространенным факторам риска развития БА относятся воздействие аллергенов, например клещей домашней пыли, шерсти животных, тараканов, пыльцы и плесени; производственные и химические ирританты, табачный дым, загрязнение воздуха, сильные эмоциональные переживания; наследственная предрасположенность, а также респираторные инфекции. На сложной и подчас противоречивой взаимосвязи между инфекционными заболеваниями и патологическими процессами, в основе развития которых лежит иммунологический феномен аллергии, стоит остановиться особо. Научные достижения последних лет позволили приоткрыть «завесу тайны» в понимании этой проблемы, и в то же время, поставили перед клиницистами большое количество нерешенных вопросов.
Так, в течение последнего десятилетия внимание клиницистов привлекает так называемая «гигиеническая гипотеза», согласно которой к развитию БА в определенной степени предрасполагает недостаточное количество инфекционных контактов в раннем детстве, а перенесенные в это время инфекции, наоборот, способствуют правильному становлению механизмов иммунной защиты детского организма и формированию «неаллергического» фенотипа. Популяционные исследования, оценивающие значение определенных инфекционных контактов (инфицирование вирусами гепатита А, простого герпеса, H. pylori, Toxoplasma
gondii) в развитии БА, свидетельствуют об их протективной роли. В то же время, кратковременные эпизоды глистной инвазии могут вызывать обострение атопических процессов
(M. Yazdanbakhsh et al., 2005).
Бактериальная инфекция также может оказывать прямо противоположное воздействие на аллергическое воспаление, то есть как стимулировать, так и тормозить его развитие. В качестве примера можно привести интересные данные о противоречивой роли входящего в состав мембраны грамнегативных бактерий эндотоксина: с одной стороны, он предупреждает формирование атопии, но одновременно является и фактором риска неатопической БА
(W. Eder et al., 2004). Накапливаются данные и об обратной взаимосвязи между инфекционными и аллергическими процессами: например, недавно было выявлено, что у пациентов с БА риск развития инвазивной пневмококковой инфекции как минимум вдвое выше, чем у лиц без этого заболевания
(T.R. Talbot et al., 2005).
Активно обсуждается вклад в развитие БА вирусных инфекций, перенесенных в первые годы жизни. Признано, что некоторые вирусы являются мощными триггерами обострений БА. В частности, при тяжелом течении бронхиолита, вызванного респираторно-синцитиальным вирусом, у детей раннего возраста в дальнейшем повышается риск сенсибилизации к распространенным пищевым и ингаляционным аллергенам, а также развития эпизодов затрудненного дыхания и БА (N. Sigurs et al., 2000).
Очевидно, в процессе дальнейшего изучения многогранных аспектов взаимосвязи патологических процессов инфекционной и аллергической природы ученых и врачей ожидает еще много интересных открытий. Приглашаем ведущих отечественных клиницистов принять участие в данной дискуссии и поделиться своими взглядами по данной проблеме.
Источник