Лазеротерапия бронхиальной астмы у детей
Почему лазер?
Лазерная терапия повышает качество и эффективность лечения в комплексе с другими мероприятиями, оказывает антиаллергическое действие, способствует насыщению крови кислородом и нормализации дыхательной функции, снижает воспаление и отек слизистой дыхательных путей, снимает бронхоспазмы, улучшает газообмен,предотвращает приступы удушья, снижает риск осложнений.
Бронхиальную астму назвали «легочная чума ХХ века». Некогда крайне редкая болезнь ныне с катастрофической скоростью расширяет позиции. В настоящее время не менее 6% всего населения имеют бронхиальную астму той или иной степени тяжести, и этот процент растет с каждым годом. Большую тревогу врачей вызывает огромное число не выявленных форм заболевания. Например, легкие формы бронхиальной астмы могут прятаться за диагнозами «обструктивный бронхит» или «хронический бронхит». Заболеваемость среди детей в некоторых регионах России достигает 20%.
В наши дни от этой болезни ежегодно погибают тысячи людей. Появилась проблема внезапной смерти от астмы. К сожалению, никакие, даже самые современные препараты не могут застраховать от этого.
Бронхиальную астму считают хроническим инфекционно-аллергическим заболеванием.
Ее симптомы: затрудненное дыхание, повторяющиеся приступы удушья, ощущение хрипов и свистов в груди, одышка, которая усиливается при обострении, приступообразный сухой кашель, который может быть и единственным признаком заболевания. Обострение (удушье) может возникать в любое время суток, но «классическими» являются ночные эпизоды.
Главный симптом астмы — удушье, особенно затруднен выдох. Легкие переполнены воздухом, а количество, пригодное для дыхания, резко сокращается. Ощущая нехватку воздуха, человек компенсирует ее усиленным и учащенным дыханием, вызывая одышку. Форсированное дыхание приводит к появлению хрипов и свистов в легких, которые вызывает воздух, проходя с большой скоростью через суженный просвет бронхов.
Часть людей обретают астму как осложнение хронических бронхитов и пневмонии. Но чаще развитие бронхиальной астмы связывают с аллергией. Ее включили в так называемую «большую тройку аллергических болезней». Ученые выяснили, что около трети людей на земле подвержены аллергии на пыль, пыльцу цветов, шерсть животных, перья птиц, почти половина имеют ту или иную степень непереносимости лекарств, синтетических веществ, табачного дыма, выхлопных газов. Все эти факторы способны вызвать у астматиков обострение бронхиальной астмы. Частота обострений определяется видом аллергена, на который у человека есть реакция, и тем, насколько часто он с ним контактирует. Например, при аллергии на пыльцу растений обострения имеют четкую сезонность: весна-лето.
Другой типичный дебют астмы: Здоровый человек перенес ОРВИ или грипп. Не долечившись, он начинает подкашливать, потом кашель становится постоянным, далее появляется одышка или хрипы в груди, а потом и первый приступ удушья.
Ежегодные эпидемии гриппа, ОРВИ, неизбежные в современных условиях, усугубляют течение астмы. В результате к аллергическому компоненту присоединяется микробная инфекция. В свою очередь, прогресс болезни ведет к непереносимости некоторых пищевых продуктов, лекарств, запахов, средств бытовой химии и т.п. Нарастание аллергических проявлений вновь утяжеляет характер заболевания. Изменяется реакция бронхов на одни и те же лекарственные препараты, в результате лекарства, помогавшие ранее, могут стать причиной ухудшения состояния.
Для астмы характерны спазм гладкой мускулатуры бронхов, воспаление и отек слизистой, скопление мокроты. Степень спазма, отека и закупорки слизью дыхательных путей определяют степень ухудшения проходимости бронхов, скоростью прогрессирования болезни. Влияют и особенности организма, условия жизни, экологическая обстановка, профессиональные вредности, курение, в том числе пассивное, длительный прием ряда лекарственных препаратов и даже проживание в квартире, стены которой поражены плесневым грибком.
Не последнюю роль в развитии заболевания играет наследственная предрасположенность. По наблюдениям врачей, почти 40% среди ближайших родственников пациентов с бронхиальной астмой – аллергики.
Современная медицина пока не располагает ни ясным представлением о природе астмы, ни единством мнения о технологиях лечения. Многие специалисты считают, что в основе развития бронхиальной астмы лежит патогенетический механизм гиперчувствительности немедленного типа, так называемый IgE-зависимый иммунный ответ, его считают основным механизмом развития аллергических заболеваний, согласно которому от момента поступления аллергена до развития симптомов заболевания проходят считанные минуты.
Однако, по наблюдениям врачей и больных астмой оказалось, что одни люди активны, работают, занимаются спортом, а другие становятся инвалидами. У одних астма протекает сравнительно легко, а у других она превращается в жестокого тирана. Одни пациенты доживают до глубокой старости, а другие умирают в расцвете лет.
Лечение астмы
Бронхиальная астма находится в сфере интересов аллерголога-иммунолога и пульмонолога. Легкими формами заболевания обычно занимаются терапевты или педиатры (в зависимости от возраста пациента).
В обследовании пациента с бронхиальной астмой важно выявить аллергены, контакт с которыми вызывает аллергическое воспаление. В настоящее время разработаны многочисленные тесты на повышенную чувствительность к бытовым, эпидермальным, грибковым аллергенам. С целью создания невосприимчивости к аллергенам, вызывающим у больного аллергическую реакцию и воспаление врач-аллерголог проводит аллерген-специфическую иммунотерапию (СИТ-терапия). Эффект от лечения тем выше, чем раньше оно начато.
В лечении бронхиальной астмы используют различные лекарственные препараты. Их дозировки, сочетания и длительность курса лечения определяет лечащий врач в зависимости от степени тяжести заболевания. В настоящее время доминирует концепция, согласно которой лечение бронхиальной астмы должно пересматриваться каждые три месяца. Если за это время болезнь была полностью скомпенсирована, то решают вопрос о снижении дозировок, если нет, то о повышении доз или о присоединении лекарственных препаратов из других фармакологических групп.
Очень важно подобрать средства, замедляющие или останавливающие прогресс болезни, что позволяет продлить жизнь, увеличить периоды комфортного состояния здоровья, сохранить активный образ жизни и трудоспособность, уберечь от инвалидности.
В период обострения важно снять приступ удушья, обусловленный сужением бронхов из-за спазма мускулатуры, отека слизистой оболочки и закупорки просвета бронхов вязким отделяемым.
Для лечения бронхиальной астмы нужна комплексная терапия, включающая медикаменты, физиотерапию, витаминотерапию, специальную дыхательную гимнастику, массаж, психотерапию. Медикаменты должен назначить лечащий врач. Прогноз для жизни при адекватном лечении и соблюдении правильного образа жизни в целом благоприятный. При неадекватном лечении, резкой отмене препаратов – высок риск развития астматического статуса, а это представляет непосредственную угрозу для жизни.
К осложнениям длительно неконтролируемой бронхиальной астмы можно отнести развитие эмфиземы легких, легочной и сердечной недостаточности. Тяжелые формы заболевания могут привести к инвалидизации человека.
Лазер ОРИОН в лечении астмы
Лазерная физиотерапия используется наряду с другими способами лечения. Лазерный луч проникает в очаг поражения и быстро снимает отек. Облегчение наступает после первых процедур. Курс лечения состоит из 6-10 процедур, которые проводятся один раз в день. Курс повторяют 2-3 раза в год. Своевременное начало терапии позволяет предупредить осложнения и значительно ускорить выздоровление. Лазерная терапия позволяет существенно снизить дозировки лекарственных препаратов, отменить медикаменты, опасные побочным действием, уменьшить разнообразие лекарственных средств. Профилактические курсы нужно проводить в весенне-осенний период, обязательно в периоды сезонных обострений ОРВИ, гриппа. Для профилактики можно использовать схему «Щит» или НЛОК.
Лазерное лечение можно сочетать с медикаментозной терапией.
Источник
Статья посвящена эффективности магнитолазерной терапии у детей с атопической бронхиальной астмой
Введение
Бронхиальная астма занимает ведущее место среди хронических заболеваний органов дыхания, развивающихся вследствие взаимодействия различных клеток и медиаторов воспаления, а также факторов внешней среды [1]. Частота встречаемости этой патологии у детей колеблется в разных странах мира, в среднем составляя от 7 до 30% [2]. Бронхиальная астма является заболеванием, которое требует длительного медикаментозного лечения в зависимости от тяжести заболевания [3].
В практической деятельности основное внимание уделяется именно фармакотерапевтическим методам лечения, однако в настоящее время остается актуальным ряд вопросов по лечению этого заболевания, особенно в детском возрасте [4]. Патогенетическое воздействие на организм больного бронхиальной астмой предполагает рациональное сочетание медикаментозных и немедикаментозных методов лечения, использование физиотерапии [5, 6]. К патогенетическим методам физиотерапии относится лазерная терапия [7].
Лазеротерапия – это использование с лечебно-профилактической целью низкоэнергетического лазерного излучения, которое является электромагнитным излучением оптического диапазона. Малые дозы лазерного излучения вызывают стимулирующий эффект, средние – обезболивающее действие, улучшение микроциркуляции, повышенные – противовоспалительное действие [8].
Проникающая способность излучения, имеющего длину волны 632,8 нм и находящегося в спектре полосы поглощения красного света, составляет несколько миллиметров. Проникающая способность излучения с длиной волны 850–890 нм (инфракрасный лазер) составляет 7–8 см [8, 9].
Лазерное излучение является одним из физических факторов, способных корригировать иммунные нарушения, которые лежат в основе патогенеза бронхиальной астмы. Предполагают, что иммуномодулирующий эффект этого вида излучения связан с влиянием на рецепторный аппарат иммунокомпетентных клеток [10, 11].
Магнитолазерная терапия – это использование лазерного излучения в сочетании с магнитным (чаще постоянным) полем. Сочетанное действие этих двух физических факторов значительно увеличивает проникающую способность лазерного излучения, уменьшает его отражение на границе раздела тканей и улучшает поглощение. Это взаимодействие приводит к повышению терапевтической эффективности терапии [9, 12].
Цель исследования: изучение динамики клинической картины у детей с атопической бронхиальной астмой в ходе магнитолазерной терапии.
Материал и методы
Нами обследовано 42 ребенка в возрасте от 5 до 18 лет, находившихся на лечении в аллергологическом отделении УЗ «Витебский областной детский клинический центр». Все дети наблюдались по поводу аллергической бронхиальной астмы. Диагноз бронхиальной астмы и степень ее тяжести установлены и подтверждены в стационаре согласно международным рекомендациям, обоснованы данными анамнеза, клиническими проявлениями заболевания [2, 3]. При постановке диагноза учитывались результаты лабораторных, инструментальных, аллергологических обследований. Исследование проходило по протоколу открытого контролируемого исследования в параллельных группах пациентов на фоне стандартной терапии основного заболевания. В качестве базисной терапии, согласно протоколам обследования и лечения Министерства здравоохранения Республики Беларусь, были назначены ингаляционные глюкокортикостероиды (и-ГКС) в низких дозах, а также короткодействующие β2-агонисты по потребности. Относительно всех детей, включенных в обследование, получено информированное согласие на участие в исследовании. Пациенты с бронхиальной астмой разделены на 2 группы. В группу А входили дети, получающие магнитолазерную терапию на область грудной клетки одновременно с базисной терапией, пациенты группы В получали только базисную терапию. Аппарат магнитолазеротерапии имел следующие характеристики: лазер красной области спектра с длиной волны 0,67±0,02 мкм, лазер ближней инфракрасной области спектра с длиной волны 0,78±0,02 мкм, постоянная магнитная насадка с магнитной индукцией 70 мТл.
Количество облучаемых точек за один сеанс 10–12. Общее время облучения – 10 мин. Общая доза облучения, полученная пациентом за 1 сеанс, – 25 Дж. При лечении детей до 12 лет экспозиции, указанные в методиках, уменьшаются вдвое. Курс магнитолазерной терапии у детей с бронхиальной астмой составляет 7–10 процедур, сеансы проводятся ежедневно в первой половине дня с учетом циркадных ритмов. Побочных реакций магнитолазерной терапии в сочетании с базисной терапией не наблюдалось ни у одного пациента, включенного в обследование.
Для оценки эффективности проводимого лечения изучали динамику клинической картины. В оценке клинических симптомов учитывали следующие показатели:
– количество обострений за 3 мес. наблюдения;
– частота использования ингаляций короткодействующих β2-агонистов;
– оценка базисной терапии за период наблюдения;
– оценка контроля над бронхиальной астмой (опросник АСТ, Asthma Control Test).
Оценку клинических данных проводили перед началом исследования, через 1 и 3 мес.
Анализируя эффективность проводимой терапии, с целью оценки контроля над бронхиальной астмой использовали тест АСТ. Для детей старше 12 лет использовали стандартный тест контроля над астмой, который включает 5 вопросов, для детей до 12 лет применяли тест из 7 вопросов (С-АСТ). Оценка теста АСТ для детей старше 12 лет: 25 баллов – полный контроль, 20–24 балла – хороший контроль, сумма менее 20 баллов – неконтролируемое течение заболевания, требующее вмешательства врача для пересмотра плана на лечения. Оценка теста С–АСТ для детей от 3 до 12 лет: 20–27 баллов – контролируемое течение, сумма менее 20 баллов – неконтролируемое течение заболевания, требующее вмешательства врача для пересмотра плана лечения.
Статистическую обработку данных проводили с использованием стандартного пакета прикладных программ Statistica 6.0. Для принятия решения о виде распределения количественного признака использовали критерий Шапиро – Уилка. При нормальном распределении использовали параметрические методы, для оценки достоверности различий между группами использовали t-критерий Стьюдента. Для описания распределения этого признака использовали среднее значение и среднее квадратическое отклонение. Для описания признака, распределение которого отличается от нормального, использовали медиану и интерквартильный интервал. Использовались непараметрические методы статистического исследования: критерий Манна – Уитни (для анализа различий в двух независимых группах по количественному признаку), критерий Вилкоксона (для анализа различий в двух зависимых группах по количественному признаку). Различия считали достоверными при р<0,05.
Результаты
Дети обеих обследуемых групп были сопоставимы по полу и возрасту (р>0,05) (табл. 1). ![Таблица 1. Характеристика детей с бронхиальной астмой, включенных в обследование Me [LQ-UQ] Таблица 1. Характеристика детей с бронхиальной астмой, включенных в обследование Me [LQ-UQ]](https://www.rmj.ru/upload/medialibrary/3e4/920-1.png)
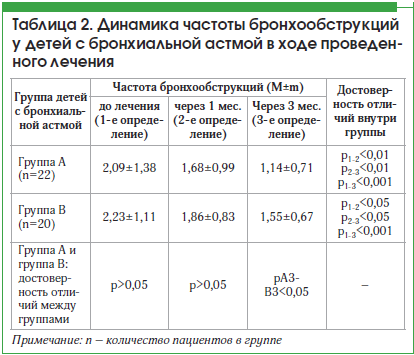
В течение 3-х месяцев наблюдения установлено, что в группе детей, получавших стандартное лечение в сочетании с магнитолазерной терапией (группа А), выявлено уменьшение частоты приступов уже через 1 мес. от начала исследования (р1-2<0,01). Через 3 мес. частота бронхообструкций достоверно отличалась от предыдущего показателя (p2–3<0,01), а также была статистически ниже, чем исходный показатель (р1-3<0,001). В группе детей, получавших только базисную терапию (группа В), статистически значимое снижение числа бронхообструкций наблюдалось через 1 и 3 мес. от начала терапии (р1-2<0,05; р1-3<0,001). Частота бронхообструкций через 3 мес. статистически значимо снизилась в группе А в сравнении с группой В (рА3–В3<0,05) (табл. 2). 
Для определения частоты использования ингаляций короткодействующих β2-агонистов пациенты отвечали на вопрос: Как часто за последние 4 нед. Вы использовали быстродействующий ингалятор (например, сальбутамол или фенотерол) или небулайзер (аэрозольный аппарат) с лекарством? Максимальная оценка в 5 баллов – ингаляции не применялись ни разу, 4 балла – один раз в неделю или реже, 3 балла – 2 или 3 раза в неделю, 2 балла – 1 или 2 раза в день, минимальная оценка 1 балл – 3 раза в день или чаще. До лечения средний балл в обеих группах достоверно не отличался. Через 1 и 3 мес. от начала лечения установлено статистически значимое повышение этого показателя в группе А (р1-2<0,01; p2-3<0,001; p1-3<0,00001). В группе В дети стали пользоваться быстродействующими ингаляторами также реже, соответственно показатель повышался через 1 и 3 мес. по сравнению с исходным (р1-2<0,05; p2–3<0,01; p1-3<0,001). В то же время следует отметить, что показатель через 3 мес. статистически значимо повысился в группе А (рА3-В3<0,01) (табл. 3). 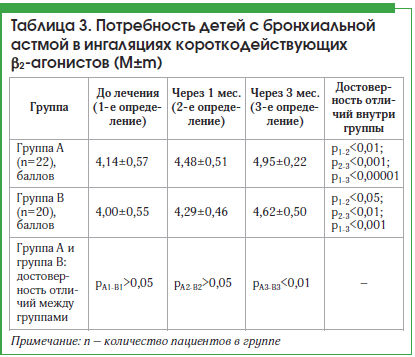
В группе пациентов, получавших магнитолазерную терапию в сочетании с базисной терапией, через 3 мес. у 8 пациентов суточная доза и-ГКС снизилась. 10 детей не нуждались в фармакотерапии после завершения наблюдения в связи с полным контролем над заболеванием и отсутствием приступов. Четверо детей продолжили базисную терапию в полном объеме. Однако следует отметить, что за время наблюдения эти пациенты перенесли острую респираторную инфекцию, что вероятно и способствовало отсутствию значительной положительной динамики и обусловило необходимость дальнейшего применения и-ГКС. В группе А не потребовалось увеличения дозы и-ГКС, а также назначения второго препарата в качестве базисной терапии. В группе В полная отмена базисной терапии через 3 мес. стала возможной только у 4-х детей. У 3-х пациентов доза и-ГКС снизилась, 10 детей продолжали получать базисную терапию в прежнем объеме. Антилейкотриеновые препараты в качестве базисной терапии добавлены в лечение 3-х пациентов в группе В. Таким образом, количество детей, нуждающихся в базисной терапии через 3 мес. от начала лечения, в группе В статистически значимо выросло по сравнению с групой А (р<0,05).
В группе А установлены достоверные отличия по результатам теста АСТ через 1 и 3 мес. от начала лечения как у детей до 12 лет, так и в старшей возрастной группе (р<0,05). В группе В показатели теста также увеличивались в процессе наблюдения, статистически значимые отличия установлены через 1 и 3 мес. от начала лечения. Однако при сопоставлении результатов АСТ-теста между группами выявлены статистически значимые различия. Через 3 мес. у детей старше 12 лет в группе А результат был достоверно выше (р<0,05). У детей младше 12 лет результат теста С-АСТ в группе А статистически значимо повысился уже через 1 мес. от начала лечения (р<0,05). Аналогичная тенденция сохранилась и через 3 мес. (р<0,05) (табл. 4).
Полученные данные свидетельствуют о том, что при назначении детям с бронхиальной астмой магнитолазерной терапии контроль над заболеванием достигается в более короткие сроки. 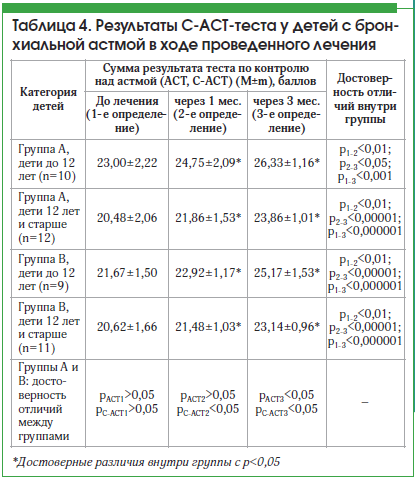
Обсуждение
В ряде исследований получены данные об эффективности лазерной терапии при бронхиальной астме. Применение лазерной акупунктуры благоприятно влияет на бронхиальную гиперреактивность у детей школьного возраста с легкой персистирующей астмой [13]. Применение магнитолазерной терапии способствует уменьшению эпизодов бронхообструкции, что приводит к сокращению использования доз ингаляций короткодействующих β2-агонистов, а также позволяет сократить сроки применения базисной терапии (и-ГКС). В то же время следует отметить, что улучшение клинической картины наблюдалось как в группе А, так и в группе В, однако назначение магнитолазерной терапии позволило в более короткие сроки снизить дозу либо полностью отменить ингаляционные глюкокортикостероиды у детей с бронхиальной астмой.
Известно, что применение комбинации медикаментозной терапии и лазеропунктуры при смешанной форме бронхиальной астмы способствует улучшению функции внешнего дыхания и бронхиальной проходимости, оказывает противовоспалительное действие, что подтверждается снижением эозинофилии и лейкоцитоза в крови, улучшением характера отделяемой мокроты [14].
Полученные нами результаты подтверждают клиническую эффективность применения магнитолазерной терапии на область грудной клетки, свидетельствуют о более быстрой отмене базисной терапии (и-ГКС) либо сокращении доз лекарственных средств, используемых для длительной противовоспалительной терапии при бронхиальной астме у детей. Использование магнитолазерной терапии позволяет в более быстрые сроки добиться контроля над заболеванием и тем самым улучшить качество жизни пациентов. Следует добавить, что метод магнитолазерной терапии безопасен, не дает побочных эффектов, может использоваться как в стационаре, так и в амбулаторно-поликлинической практике, обладает высокой экономической эффективностью за счет относительно невысокой стоимости одной процедуры.
Выводы
1. Применение магнитолазерной терапии у детей с бронхиальной астмой в комбинации с базисной фармакотерапией сопровождается уменьшением частоты бронхообструкций и более быстрым достижением контроля над заболеванием.
2. Метод магнитолазерной терапии способствует сокращению сроков использования базисной терапии.
3. Магнитолазерная терапия у детей с бронхиальной астмой хорошо переносится и не сопровождается развитием побочных эффектов.
Источник

