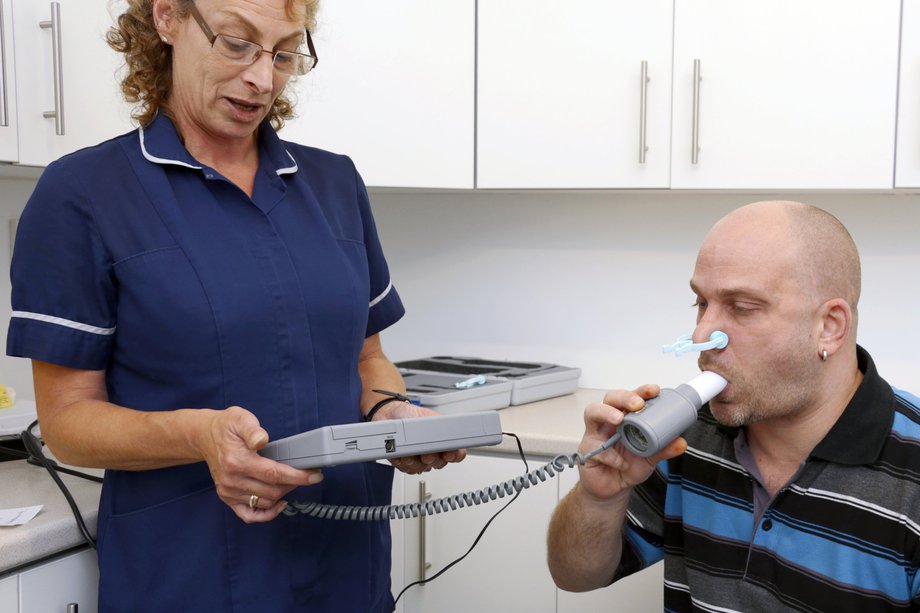
Моноклональные препараты для лечения астмы
Новые биологические препараты на основе моноклональных антител обещают перевести лечение астмы в область персонализированной медицины.
По данным ВОЗ, во всем мире бронхиальной астмой страдают около 235 млн. людей. Эксперты считают, что 20% имеют тяжелую форму болезни, среди них у 20% астма неконтролируемая (симптомы, в том числе кашель, свистящие хрипы, приступы удушья, обычно наблюдаются и днем, и ночью, мешая нормальной работе и заставляя постоянно использовать ингалятор).
Чаще всего астматики лечатся ингаляционными глюкокортикостероидами, но для больных тяжелой формой астмы стандартная терапия обычно не работает, потому что у астмы много причин и форм. Так, решающую роль в некоторых формах астмы играют интерлейкины – информационные молекулы, секретируемые клетками иммунной системы. Интерлейкин-5 (ИЛ-5), например, стимулирует созревание эозинофилов и их миграцию из костного мозга. Эозинофилы защищают от инфекций, но могут вызывать в легких воспаление в ответ на действие аллергенов. Интерлейкин-13 (ИЛ-13) и интерлейкин-4 (ИЛ-4) помогают эозинофилам проникать в легочную ткань, провоцируют клетки эпителия на производство избыточной слизи и повышают жесткость дыхательных путей.
Под влиянием ИЛ-13 клетки эпителия легких вырабатывают еще одно вещество, которое участвует в развитии хронического воспаления при бронхиальной астме,– белок периостин, причем при неконтролируемом течении болезни его уровень повышается, коррелируя с повышением ИЛ-13.
Когда фармацевты и врачи это поняли, то приступили к созданию биологической таргетной терапии, направленной на блокирование этих интерлейкинов. Так была разработана серия новых препаратов на основе моноклональных антител (вырабатываются иммунными клетками, принадлежащими к одному клеточному клону).

Что предлагают фармкомпании
У некоторых биопрепаратов была непростая судьба. Так, первые испытания меполизумаба в конце 1990-х годов с треском провалились, и GlaxoSmithKline положила лекарство на полку. В результате похожей ситуации Schering Plough (сейчас входит в состав Merck) прекратила разработку реслизумаба и продала права на него другой компании.
Оба лекарства блокируют интерлейкин-5 (ИЛ-5). Ученые предположили, что так можно снизить количество эозинофилов и, соответственно, уменьшить симптомы астмы. Они думали, что помогут всем астматикам, но оказалось, что не у всех больных астму провоцирует интерлейкин-5.
Сегодня уже понятно: первые испытания были неудачными потому, что тестировали препарат не на тех пациентах. В 2009 году, когда испытания меполизумаба возобновились, было доказано, что месячный курс подкожных инъекций снижает частоту астматических приступов на 53% по сравнению с группой плацебо и позволяет уменьшить ежедневную дозу оральных кортикостероидов без потери контроля над астмой у людей с высоким уровнем эозинофилов, который не снижается кортикостероидами. В конце 2015 года меполизумаб был одобрен в Европе и США для поддерживающего лечения пациентов старше 12 лет с тяжелой астмой и эозинофилией.
Клинические испытания реслизумаба израильской компании Teva Pharmaceutical Industries завершились сентябре 2014 года, доказав, что 30-дневный курс инъекций препарата пациентам с неконтролируемой астмой и повышенным уровнем эозинофилов сокращает число приступов на 50–60% по сравнению с группой плацебо. В 2016 году препарат был зарегистрирован в Европе и США для лечения взрослых пациентов с тяжелыми формами эозинофильной бронхиальной астмы.
Бенрализумаб британской компании AstraZeneca имеет несколько иной принцип действия: он блокирует не собственно интерлейкин-5, а его рецептор, снижая уровень эозинофилов в мокроте и крови. III фаза клинических испытаний, которая закончилась в мае 2017-го, показала, что через 28 недель после начала терапии бенрализумаб сокращает потребление глюкокортикоидов на 75% (на 25% в группе плацебо), а частота приступов астмы в годовом исчислении снижается на 55–70%. Средство предназначено для подкожного введения раз в четыре или восемь недель. Заявка на регистрацию лекарства была подана в Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США в ноябре 2016 года.
Фармкомпании занимаются и другими интерлейкинами – ИЛ-13 и ИЛ-4. В 2016 году Roche представила результаты III фазы испытаний препарата лебрикизумаб для пациентов с повышенным уровнем сывороточного периостина или эозинофилов крови. Увы, эффект оказался менее выраженным, чем в исследованиях II фазы, где у больных с повышенным уровнем периостина отмечалось 60-процентное снижение числа астматических приступов.
Хорошие перспективы у дупилумаба, созданного совместно компаниями Regeneron и Sanofi. Действие препарата основано на ингибировании общего рецептора ИЛ-4 и ИЛ-13. Дупилумаб уже зарегистрирован в США как средство для лечения атопического дерматита и сейчас проходит III фазу клинических испытаний для применения при неконтролируемой персистирующей астме у взрослых и подростков 11–16 лет. Компании планируют к концу 2017-го подать заявку в Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США на лицензирование препарата. Сейчас продолжаются испытания дупилумаба для лечения носовых полипов и эозинофильного эзофагита.

За и против
Главный недостаток биологических препаратов – их дороговизна. В США годовой курс омализумаба стоит $10 000, меполизумаба – $32 500.
Есть и другие недостатки. Ведь даже среди астматиков с «правильным» биологическим профилем трудно определить, блокатор какого интерлейкина давать тому или иному пациенту, поскольку биомаркеры, привязанные к определенному лекарству, могут сочетаться. «Что давать больным: ингибитор ИЛ-5 или блокатор ИЛ-13? – вопрошает Лиам Хини, исследователь астмы в Университете Квинс в Белфасте (Великобритания) и руководитель Программы стратификации рефрактерной астмы (RASP).– Мы не можем точно сказать».
Некоторые врачи вообще скептически относятся к биопрепаратам. Так, пульмонолог Парамесваран Наир из Университета Макмастера в Гамильтоне, провинция Онтарио, Канада, уверен, что неконтролируемая астма – это чаще всего результат неправильного или нерегулярного использования имеющихся средств. Даже в группе плацебо на III фазе испытаний метолизумаба число приступов снизилось на 50%, подчеркивает он. Врач считает, что более точное назначение существующих лекарств и работа по приучению больных к регулярному и правильному их использованию позволит достичь тех же результатов, что и дорогостоящие моноклональные антитела.
Кроме того, биопрепараты – это не панацея. «Конечно, мы видим значительную разницу в количестве осложнений, но это еще не полное излечение. В идеале мы хотели бы создать препарат, который позволил бы полностью отменить любую другую терапию», – заявляет Энтони Монтанаро, глава отделения аллергии и клинического иммунологии Орегонского университета здоровья и науки в Портленде (США).
Но несмотря на все недостатки, биопрепараты – это настоящий прорыв, уверена Анна Мёрфи, фармацевт-консультант по респираторным заболеваниям университетских клиник Лестерского траста Национальной службы здравоохранения Великобритании: «Это новый шаг на пути к персонализированной медицине. Мне приятно думать, что когда-нибудь можно будет сказать: «Давайте выясним, что провоцирует астму у этого больного, и подберем ему правильное лечение».
Источник: The Pharmaceutical Journal
Источник
По крайней мере 360 млн. людей во всем мире страдают бронхиальной астмой (БА)*.1 В России согласно опубликованным данным в 2012 и 2014 году распространённость БА среди взрослого населения составляет 6,9%2, а среди детей и подростков – около 10%.3 Для того, чтобы контролировать клинические проявления болезни и предотвратить развитие осложнений у пациентов с БА, очень важно своевременно назначить соответствующее лечение. Современная терапия препаратами моноклональных антител (мАТ)** предоставляет пациентам и медицинскому сообществу дополнительные возможности в попытке достижения контроля над заболеванием.
Несмотря на то, что большинство пациентов, страдающих БА, хорошо отвечают на традиционную терапию, достигая контроля заболевания, часть больных (20–30%) с трудными для терапии фенотипами БА могут быть рефрактерны к традиционной терапии. К таким фенотипам относятся: тяжелая атопическая БА, БА при ожирении, БА курильщика, БА с поздним дебютом, БА с фиксированной бронхиальной обструкцией.1,4 На лечение данных категорий пациентов тратится более половины всех средств, требуемых для лечения всех больных БА. Именно у этих больных отмечается высокая частота обострений и обращений за неотложной медицинской помощью.1 Поэтому для них современные подходы к лечению астмы с использованием терапии моноклональными антителами могут стать ключом к контролю над заболеванием и полноценной жизни. Биологические препараты, представляющие собой мАТ, являются многообещающей терапевтической опцией для пациентов с резистентной к традиционной терапии БА, так как они направлены на борьбу с конкретными механизмами, контроля над которыми не удается достичь при применении других терапевтических приемов1.
Современным передовым стандартом, разработанным в конце 1990-х годов, являются человеческие мАТ, произведенные с помощью технологии рекомбинантных ДНК. Они могут создаваться при помощи одного из следующих вариантов:
- Мыши с ДНК, измененной при помощи генетической инженерии таким образом, что они производят антитела, содержащие участки, полностью соответствующие антителам человека;
- Технология фагового дисплея, использующая генетические особенности вирусов, для конструирования высокоспецифичных мАТ.
После этого, полученные терапевтические антитела могут производиться в биотехнологических системах на основе клеток человека и животных.
При клиническом применении мАТ в организме человека действуют несколькими способами:
- Запуск процессов в иммунной системе. В этом случае мАТ «помечают» клетки для уничтожения иммунной системой;
- Блокада рецепторов. Антитела связываются с рецепторами, не запуская реакции со стороны иммунной системы. При данном способе они действуют в качестве блокатора связывания сигнальных молекул с этим рецептором и не происходит передача сигнала;
- Захват сигнальных молекул. мАТ связываются с сигнальными молекулами, прерывая передачу сигнала и предотвращая их взаимодействие с клетками.
Нужно отметить, что терапевтические мАТ по структуре довольно сильно отличаются от большинства низкомолекулярных фармацевтических препаратов. Они намного крупнее и сложнее. Поэтому в отличие от низкомолекулярных веществ, которые могут приниматься внутрь, мАТ должны вводиться подкожно или внутривенно. Это может стать барьером для пациентов, поскольку многие из них настороженно относятся к инъекционной терапии. Однако, если сравнивать терапию моноклональными антителами с традиционной, она имеет ряд преимуществ, которые могут стать решающими для пациентов при принятии решения.5
Сегодня в Соединенных Штатах Америки и Европе одобрены для клинического использования более 30 моноклональных антител, и более чем 200 иммуномодулирующих и не иммуномодулирующих мАТ находятся в процессе клинической разработки для использования по столь разнообразным показаниям к применению, как аллергия, болезнь Альцгеймера, сердечно-сосудистые заболевания, инфекционные заболевания и мышечная слабость.5
Таким образом можно говорить о том, что возможно мАТ станут решением для контроля над многими заболеваниями.
О Санофи
Санофи – глобальная биофармацевтическая компания, миссия которой – оказывать поддержку тем, кто сталкивается с различными проблемами со здоровьем.
С помощью наших вакцин мы стремимся защищать людей от болезней, а наши препараты помогают облегчить течение многих заболеваний и повысить качество жизни как пациентов с редкими, так и распространенными хроническими заболеваниями.
Более 100 тысяч сотрудников Санофи в 100 странах мира ежедневно работают для того, чтобы превращать научные инновации в конкретные решения в области здравоохранения.
_____________________
*Бронхиальная астма – гетерогенное заболевание, характеризующееся хроническим воспалением дыхательных путей, наличием респираторных симптомов, таких как свистящие хрипы, одышка, заложенность в груди и кашель, которые варьируют по времени и интенсивности и проявляются вместе с вариабельной обструкцией дыхательных путей.1
** Моноклональные антитела (мАТ) – это химически и иммунологически однородные антитела, вырабатываемые клетками, принадлежащими к одному клеточному клону, то есть произошедшими из одной клетки предшественницы, и используемые в качестве лабораторных реагентов для различных анализов. Также мАТ используются в качестве терапевтических средств для лечения ряда заболеваний.
_________________________
1. Согласительный доклад объединенной группы экспертов. ТЯЖЕЛАЯ БРОНХИАЛЬНАЯ АСТМА. Ассоциация русскоговорящих специалистов в области респираторной медицины. Российское респираторное общество. Российская ассоциация аллергологов и клинических иммунологов. 2018, 25 с. Электронный ресурс: https://spulmo.ru/obrazovatelnye-resursy/federalnye-klinicheskie-rekomendatsii/ Дата доступа на 15.11.2018
2. Chuchalin A.G., Khaltaev N., Аntonov N. Chronic respiratory diseases and risk factors in 12 regions of the Russian Federation // International Journal of COPD 2014:9 963–974.
3. Национальная программа «Бронхиальная астма у детей. Стратегия лечения и профилактика» , IV издание. — М., 2012 — 182 с.
4. Федеральные клинические рекомендации по диагностике и лечению бронхиальной астмы. МОО Россйиское респираторное общество, ММО Педиатрическое респираторное общество.
2016, 76 с.
5. Foltz IN, Karow M, Wasserman SM. Evolution and emergence of therapeutic monoclonal antibodies: what cardiologists need to know. Circulation. 2013;127(22):2222-2230.
Источник