Необратимый компонент бронхиальной астмы

Общая аэрокриотерапия больных бронхиальной астмой
(для специалистов, статья по материалам krio.by) 
Современное представление о бронхиальной астме, отраженное в международных нормативных документах (5), трактует это заболевание как хроническое аллергическое воспаление, приводящее к формированию полностью или частично обратимой обструкции бронхов.
Бронхиальная обструкция при БА характеризуется изменчивостью по своей выраженности и часто является обратимой либо спонтанно, либо под влиянием лечения (5). У больных БА различают обратимый и необратимый компоненты бронхообструктивного синдрома.
Обратимый компонент обструкции бронхов определяет возможности лечебного воздействия и включает в себя бронхоспазм, который доминирует у больных БА, воспалительный отек слизистой бронхов и обтурацию дыхательных путей слизью вследствие гипер- и дискринии с развитием местных и общих иммунных сдвигов, проявляющихся при разных формах астмы различными вариантами сенсибилизации.
Необратимый компонент обструкции развивается у больных БА тяжелой степени тяжести и определяется наличием структурных изменений стенок бронхов и экспираторного коллапса мелких дыхательных путей вследствие развивающейся эмфиземы (8).
Современные схемы лечения пациентов с заболеваниями дыхательных пу-тей практически всегда включают различные виды ингаляционной терапии противовоспалительными и бронхолитическими средствами. В международных нормативных документах по лечению БА (5) основное внимание уделено именно ингаляционному применению лекарственных средств. Вместе с тем его эффективность определяется особенностями клинической картины заболевания, методом генерации аэрозоля, правильностью дыхательного маневра и другими причинами.
Несмотря на успехи медикаментозной терапии, проблема ликвидации воспаления и бронхиальной обструкции у больных БА сегодня во многих случаях остается нерешенной. В связи с этим актуален поиск немедикаментозных методов лечения, обладающих противовоспалительным, бронхолитическим и иммуномодулирующим лечебными эффектами и способных улучшить течение БА.
Одним из таких методов является общая аэрокриотерапия (ОАКТ — аппарат КРИОСАУНА) — кратковременное воздействие на кожные покровы пациента газовой средой, температура которой составляет от минус 130 до минус 170° С. Целью этой процедуры является охлаждение кожных покровов пациента в сочетании с минимальным распространением переохлаждения в глубину тела (2, 3).
В условиях естественно-конвективного теплообмена между телом пациента и охлаждающей газовой средой, значение температуры однозначно определяет интенсивность отвода теплоты. Правильный подбор температуры газа и продолжительности воздействия определяют эффективность и безопасность процедуры.
В этих условиях наиболее эффективны процедуры температурой от — 160 — — 130 °С.
Повышение тем-пературы до — 120° С и более приводит к качественным изменениям характера взаимодействия пациента (объекта охлаждения) и охлаждающей среды — процедура приобретает выраженный гипотермический характер (2).
В этих условиях достижение лечебного эффекта требует увеличения продолжительности воздействия, что повышает вероятность переохлаждения пациента и определяет его дискомфорт от охлаждения поверхности кожи.
Общая криотерапия в диапазоне температур от — 160 до — 130 °С по ощущениям и теп-лопотерям аналогична воздействию воды с температурой 10—14 °С и справедливо может быть верифицирована как низкотемпературная газовая гипотермия.
Однако, назначение процедур минимальной продолжительности резко снижает лечебный результат процедуры,
так как эффективное воздействие холод оказывает во второй фазе процедуры. Исходя из этого, наиболее эффективны процедуры длительностью более 60 с (4).
При общем воздействии холода у больных наступает кратковременный реактивный спазм поверхностных сосудов
с последующей постреактивной гиперемией и компенсаторным повышением температуры кожи в течение 1,5 часов.
После процедуры у больных происходит стойкое торможение иммунного ответа (1,6), уменьшается инфильтрация тканей, наряду с активацией пролиферации
и репаративной регенерации. У лиц с иммунными дефектами на фоне уменьшения клинических признаков воспаления замедляется дифференцировка Т-лимфоцитов и разрушаются иммуноглобулины G и М, снижается скорость реакции торможения лейкоцитов и увеличивается скорость их миграции.
Реактивные изменения сосудистого тонуса способствуют усилению сократительной способности миокарда, снижению артериального давления, повышению кровенаполнения органов и тканей, а также повышению синтеза и выделения тропных гормонов (р-эндорфин, АКТГ)
и усилению метаболизма. В результате курса процедур
у больных БА усиливается функция внешнего дыхания, восстанавливается нормальная структура сна (4).
Выраженная синдромно-патогенетическая направленность метода общей аэрокриотерапии позволяет предположить ее высокую эффективность в лечении больных бронхиальной астмой (7).
Показания и противопоказания к применению метода общей аэрокриотерапии.
Процедуры криосауны показаны больным:
- бронхиальной астмой инфекционно-аллергической и смешанной форм,
- больным БА с сопуствующими заболеваниями:
- неспецифическим ревматоидным полиартритом,
- аутоиммунным тиреоидитом,
- ожогами, заболеваниями и травмами суставов, связок и сухожилий,
- неспецифическим язвенным колитом,
- системной красной волчанкой,
- системными заболеваниями соединительной ткани,
- кожными заболеваниями аллергического генеза.
Процедуры ОАКТ противопоказаны больным с:
- заболеваниями периферических сосудов (болезнь Рейно, облитерирующий эндартериит, варикозная болезнь),
- гиперчувствительностью к холодовому фактору.
ЭФФЕКТИВНОСТЬ ИСПОЛЬЗОВАНИЯ МЕТОДА
Для определения эффективности криосауны обследовано
89 больных бронхи-альной астмой средней степени тяжести
в фазе нестойкой ремиссии. Методом рандомизации больные
БА были разделены на группу наблюдения (65 больных), получавшую в комплексе лечения курс ОАКТ и группу сравнения (24 больных), получавшую традиционное медикаментозное лечение.
Воздействие холодом проводили в криокамере, где
с помощью паров жидкого азота достигали снижение температуры воздуха до -120-130°С. Продолжительность первой процедуры составляла 30 с. В последующих процедурах осуществляли увеличение продолжительности процедуры на 30 с, доводя до 180 с, которую поддерживали до конца курса.
В результате курса криосауны у большинства больных БА прекратился кашель, мокрота к концу лечения отсутствовала у 34 (52%) больных БА,
а у остальных снижалась ее вязкость
и улучшалось отделение, уменьшились или прекратились сухие хрипы в легких.
Общая сумма баллов оценки клинического статуса больных БА группы наблюдения снизилась с 13,4±0,4 до 4,2±0,9 (р<0,01), группы сравнения — с 11,5±0,5 до 6,1±0,8 баллов (р<0,01).
По динамике инструментальных показателей было выявлено несколько типов реакций больных БА на ОАКТ: 1). Постепенный прирост скоростных показателей к концу курса лечения (47 больных, 72%); 2). Увеличение показателей к 3-4-й процедуре с последующим постепенным снижением до исходных (14 пациентов, 22%); 3). Отсутствие динамики ФВД к концу курса лечения (4 пациента, 6%).
В процессе курса криосауны значимо увеличились скоростные показатели ФВД. У больных БА первой группы наблюдали прирост показателей петли «поток-объем»: ЖЕЛ — с 87±1,4 до 95±2,3, OФB1 — с 76±2,8 до 83,1±1,6 (р<0,05), ПОС — с 74±1,6 до 86±3,6, МОС25 — с 53+1,7 до 57±2,9 (р<0,05), МОС50 — с 45+3,8 до 52±2,1 (р<0,05), МОС75 — с 43±3,2 до 45±2,7 (р<0,05), СОС25-75- с 46±2,7 до 47±2,5 (% от должного значения).
У больных БА второй группы в результате курса криосауны прирост основных скоростных и объемных показателей кривой «поток-объем» к 5-й процедуре был менее выражен: ЖЕЛ увеличивалась с 81±2,8 до 86±1,4, OФB1 — с 53±1,2 до 57±3,2 (р<0,05), ПОС — с 53±3,9 до 58±3,2 (р<0,05), МОС25- с 41±1,5 до 44±0,9 (р<0,05), МОС50 — с 36±1,4 до 41±1,2 (р<0,05), МОС75 — с 29±1,3 до 34±2,0 (р<0,05), СОС25-75- с 36±2,6 до 43±1,9 (р<0,05) (% от должного значения) (р<0,05). У больных БА группы сравнения показатели ФВД улучшились в еще меньшей степени.
Под действием криосауны у 31 больных БА с положительной бронхолитической пробой (63% от больных данной группы) выявлено значимое снижение прироста скоростных показателей петли «поток-объем» на ингаляцию сальбутамола, что свидетельствует об уменьшении бронхоспазма и гиперреоактивности бронхов под влиянием курса криосауны. Обнаружена сильная корреляционная связь (r=0,64, р<0,05) между реакцией на сальбутамол и приростом скоростных и объемных показателей петли «поток-объем» за курс лечения.
Через 15 мин после процедуры ОАКТ выявлен прирост ПСВ у больных БА первой группы на 13±З,1%, а у пациентов БА второй группы (после 5-й процедуры) — на 8±4%. Выявлена отрицательная корреляция между динамикой частоты дыхания и выраженностью прироста ПСВ (г=-0,65, р<0,05), что свидетельствует о преимущественно рефлекторном влиянии криосауны на механизмы регуляции дыхания.
Под действием ОАКТ значимо (р<0,05) уменьшилось количество пациентов с преобладанием симпатических влияний и возросло с 58 до 74% (р<0,01) число больных БА с нормотонией. В процессе курса криосауны произошла коррекция вегетативного тонуса и к концу курса лечения у лиц с исходным преобладанием парасимпатической иннервации перехода к симпатйкотонии не наблюдали. После курса лечения у больных БА группы сравнения перехода ваготонии в симпати-котонию не произошло, что подтверждает вегетокорригирующий эффект ОАКТ.
В результате курса криосауны количество эозинофилов в мокроте у 37 (57%) больных БА уменьшилось с 2±0,4 до 1,4±0,2 баллов (р<0,05), а лейкоцитов — с 2,1±0,3 до 1,5±0,3 баллов (р<0,05). Для оценки имуннокорригирующего действия ОАКТ были выполнены исследования иммунологических показателей у 40 больных БА (средний возраст 26,7±1,5 лет) до и после курса процедур.
Полученные результаты исследования сравнивали с аналогичными показателями иммунитета 20 практически здоровых лиц (средний возраст 20,5±0,5 лет), которые добровольно согласились пройти курс криосауны. Исходные показатели иммунитета у больных БА достоверно отличались от исходных показателей у здоровых лиц. Так, у больных БА было больше CD4+ и меньше CD8+ и CD25+, чем аналогичных популяций Т — лимфоцитов у здоровых лиц.
Отмечено, что способность лимфоцитов периферической крови продуцировать ИЛ-2 у больных БА была значительно ниже, чем у здоровых.
После курса ОАКТ распределение лимфоцитов указанных субпопуляций не изменялось, а также не было выявлено устойчивого повышения продукции лимфоцитарного ИЛ-2 ни у здоровых лиц, ни у больных БА, хотя в начале курса криосауны было зарегистрировано некоторое увеличение секреции этого цитокина в обеих группах.
В отличие от здоровых, у больных БА отмечено некоторое нарастание спонтанного уровня ИЛ-4. Однако повышение продукции этого цитокина парадоксальным образом ассоциировалось со снижением уровня ИЛ-4 в сыворотке крови. Причиной этого несоответствия, по всей видимости, явилось то, что основным источником сывороточного ИЛ-4 являются не лимфоциты периферической крови, а Т-хелперы и тучные клетки, расположенные в тканях и вовлеченные в аллергическое воспаление.
С уменьшением активности воспаления снижалась и продукция ИЛ-4 клетками, находящимися в тканях, что и обусловлено снижение уровня сывороточного ИЛ-4.
ИТОГИ ПРИМЕНЕНИЯ КРИОТЕРАИИ У БОЛЬНЫХ БРОНХИАЛЬНОЙ АСТМОЙ:
криосауны оказывала выраженное действие на реакции естественного иммунитета, которые исследовали путем определения естественной цитотоксичности лимфоцитов (активность НК-клеток) и бактерицидной активности фагоцитирующих клеток (НСТ-тест).
И у здоровых и у больных БА отмечено достоверное повышение активности НК-клеток до уровней, позволяющих эффективно осуществлять защиту от внутриклеточных инфекционных агентов, а также разрушать появившиеся дефектные клетки.
Аналогичным образом в обеих группах повысилась и спонтанная бактерицидная активность лейкоцитов, определяющая ранние события в противоинфекционных реакциях. Тем не менее, мы не наблюдали у больных БА существенных изменений общей бактерицидной активности лейкоцитов (стимулированный НСТ-тест), возможно, из-за нарушения гранулоцитопоэза, наблюдаемого у больных БА.
Проведёнными исследованиями установлено, что ОАКТ в восстановительном лечении больных БА оказывают выраженное воздействие на основные звенья патогенети-ческих механизмов воспалительного процесса, бронхообструктивного синдрома, нарушения дренажной функции бронхов, имуннопатологического синдрома.
Полученные при исследовании данные позволяют считать, что ОАКТ способствует улучшению бронхиальной проходимости у больных БА посредством противовоспалительного воздействия и значимого повышения естественной резистентности. Наиболее эффективна криосауны у больных с инфекционно-аллергической формой БА.
ЛИТЕРАТУРА
- Айрапетова Н.С. и др. Применение криомассажа грудной клетки у больных хро ническим обструктивным бронхитом. // Вопр. курортол. — 2001. — №6. — С 16-19.
- Баранов А.Ю., Кидалов В.Н. Лечение холодом. Криомедицина.- СПб.: Атон, 1999.-272 с.
- Баранов А.Ю., Кидалов В.Н. Лечение холодом. М: Апрель, 2000,160 с.
- Боголюбов В.М., Пономаренко Г.Н. Общая физиотерапия: Учебник. -М.:Медицина, 1999. — 432 с.
- Глобальная стратегия лечения и профилактики бронхиальной астмы / Под. ред. АГ.Чучалина. — М.: Атмосфера, 2002. -160 с.
- Григорьева В.Д., Суздальницкий Д.В., Криотерапия. // Вопр. курортол. — 1991. — №5.-С. 65-71.
- Пономаренко Г.Н. Физические методы лечения — 2-е изд. перераб., доп. — СПб.:ВМедА,2002.
- Середа В.П., Пономаренко Г.Н., Свистов А.С. Ингаляционная терапия хронических обструктивных болезней легких. — СПб, 2004. — 222 с.
Источник

Бронхиальная астма (БА) широко распространена в современном мире. Ею болеет каждый восьмой житель Европы. Для успешного лечения и профилактики заболевания необходимо знать его причины и особенности развития.
Именно поэтому изучению патогенеза бронхиальной астмы уделяется большое внимание. Подробнее об этом – далее в статье.
Что такое бронхиальная астма

Бронхиальная астма – это хроническая болезнь, которая характеризуется поражением дыхательных путей. Основное ее проявление – рецидивирующие приступы обструкции, то есть закупорки, бронхов. Во время приступа больному тяжело сделать выдох из-за того, что бронхи спазмируются на высоте вдоха.
У астматиков с продолжительным и тяжелым течением бронхиальной астмы развиваются необратимые изменения в дыхательной системе. Разрастается соединительная ткань в легких, развивается пневмосклероз, истончаются альвеолы (эта патология получила название «эмфизема»). Это еще больше усугубляет течение заболевания и усиливает дыхательную недостаточность.
В основе патофизиологии бронхиальной астмы лежит повышенная чувствительность бронхов к различным провоцирующим факторам, причем эти факторы индивидуальны для каждого.
Этиология и формы бронхиальной астмы

Важнейшую роль в этиологии бронхиальной астмы отводят аллергическому фактору. Провокаторы заболевания делятся на две большие группы: эндоаллергены (вырабатываются внутри организма) и экзоаллергены (поступают извне). Чаще причиной заболевания становится вторая группа провоцирующих факторов. К ним относятся:
- Инфекционные возбудители – вирусы, бактерии, грибки, простейшие.
- Раздражители растительного происхождения – пыльца растений, пух тополя.
- Аллергены животного происхождения – шерсть, перья, слюна, пух.
- Бытовые аллергены – пыль, бытовая химия.
- Пищевые продукты – чаще всего аллергическую реакцию вызывают орехи, мед, шоколад, помидоры.
- Медикаменты – ацетилсалициловая кислота, антибиотики.
У некоторых больных проявления астмы возникают при определенных погодных условиях. Особенно плохо переносят астматики дождь, высокую влажность, холод. В этом случае для БА характерно отсутствие приступов, если нет воздействия внешних раздражителей.
В ходе многочисленных исследований американские ученые установили, что стресс также может быть пусковым механизмом в развитии приступов. Он способен стать первопричиной болезни, а также усугубить уже имеющуюся бронхиальную астму.
В зависимости от природы и особенностей течения заболевания выделяют следующие формы БА:
- Атопическая – развивается вследствие воздействия аллергенов неинфекционной природы.
- Инфекционно-зависимая – приступ астмы возникает после перенесенных инфекций.
- Глюкокортикоидная – в ее основе лежит нарушение баланса кортикостероидных гормонов.
- Нервно-психическая – обструкция бронхов происходит вследствие длительного стресса.
- Аспириновая – прием лекарств, содержащих ацетилсалициловую кислоту, приводит к развитию приступа удушья.
- Астма физического напряжения – заболевание проявляется после физических нагрузок.
Общая схема патогенеза бронхиальной астмы
В основе патогенеза бронхиальной астмы лежит воспаление в стенке бронхов. Любое воспаление сопровождается повышенной проницаемостью стенок сосудов.
В результате этого плазма (жидкая часть крови) просачивается через них. Жидкость накапливается в слизистой бронха, развивается отек. Просвет органа сужается, затрудняется прохождение воздуха.
Но почему у одних людей при попадании аллергена развивается воспалительный процесс в дыхательной системе, а другие никак не реагируют на него? Ученые долго думали над этим вопросом и пришли к выводу, что все дело в наследственной предрасположенности.
У некоторых людей с рождения повышена активность особых клеток крови – Т-лимфоцитов-хелперов 2 типа. Из-за этого у них выделяется большое количество иммуноглобулина Е (IgE) – белка, провоцирующего аллергическую реакцию.
Активный синтез IgE приводит к дегрануляции (повреждению) тучных клеток, которые находятся на стенке бронхов. Они начинают высвобождать медиаторы воспаления. Именно из-за этих веществ повышается проницаемость стенок сосудов, и развивается воспалительный процесс.
Но воспаление – лишь один из механизмов развития бронхиальной астмы. Помимо него, в развитии приступа принимает участие спазм бронхов. Гладкая мускулатура этого трубчатого органа резко сокращается, что приводит к перекрытию его просвета.
Не менее важную роль в развитии приступа БА играет повышенная секреция слизи клетками эпителия бронхов, выстилающего внутреннюю поверхность его стенки. Таким образом, в патогенезе бронхиальной астмы и развитии удушья можно выделить три основных фактора:
- воспаление в стенке бронхов;
- повышенная реактивность бронхиального дерева, из-за чего спазмируются мышцы этого органа;
- увеличенная выработка слизи эпителиальными клетками.
В общем патогенез бронхиальной астмы можно разделить на три этапа:
- Иммунологический – возникает при первом контакте организма с аллергическим агентом. Характеризуется активацией клеток крови и выработкой IgE.
- Иммунохимический – развивается при последующих контактах с раздражителем. Уже выработанные иммуноглобулины запускают развитие реакции в бронхиальном дереве, которая сопровождается синтезом медиаторов воспаления.
- Патофизиологический – проявляется активными изменениями в стенке бронха, описанными ранее. У больного затрудняется дыхание, появляются свистящие хрипы.
У астматиков, как и у аллергиков, в крови повышается количество эозинофилов. Эти клетки относятся к группе лейкоцитов.
Они повреждают реснички на эпителии бронхов, ухудшая тем самым эвакуацию слизи, и провоцируют изменения в тканях. Их количество в общем анализе крови более 6% говорит в пользу диагноза бронхиальной астмы.
Особенности патогенеза разных форм астмы
Этиология и патогенез бронхиальной астмы тесно взаимосвязаны. Фактор, который привел к приступу, определяет механизм его развития. Далее мы подробно разберем механизмы развития разных форм БА.
Атопическая форма
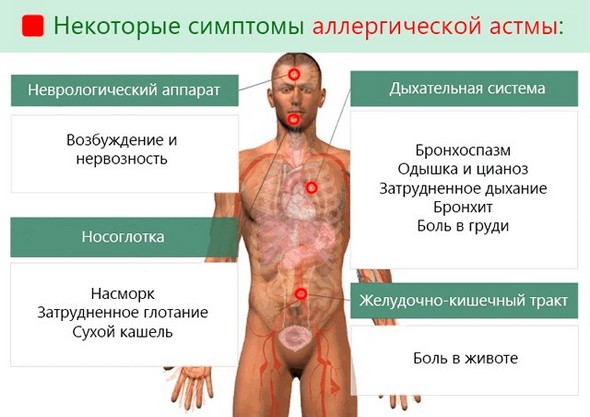
Это наиболее распространенная разновидность заболевания. Она развивается при повышенной чувствительности бронхов к аллергенам неинфекционной природы: бытовым, животным, растительным.
Особенность механизма развития бронхиальной астмы по атопическому типу заключается в его многоэтапности. Иммунологическая и иммунохимическая фазы проходят аналогично описанным в предыдущем разделе. А патофизиологический этап подразделяют еще на две стадии: раннюю и позднюю.
Ранняя реакция начинается в период от несколько минут до 2 часов после воздействия аллергенов. При этом слизистая стенки бронхов отекает, повышается выделение секрета, мускулатура спазмируется. Происходит закупорка просвета органа, прохождение воздуха затрудняется.
Поздняя стадия развивается примерно через 6 часов после действия раздражителя. Она характеризуется наличием стойкого воспаления в бронхах даже после спадания отека и прекращения спазма. Если не начать своевременное лечение, мышечная ткань органа заменяется соединительной. Данный процесс необратим.
Инфекционно-зависимая форма

Инфекционно-зависимая форма БА характерна для людей зрелого возраста. Она является осложнением перенесенных ранее острых респираторных вирусных инфекций, пневмонии, бронхита и других патологий органов дыхания.
Данная форма астмы характеризуется медленным развитием. Отек бронхов нарастает постепенно, состояние больного ухудшается на протяжении длительного времени. Пик заболевания наступает через две – три недели после перенесенной инфекции.
Течение инфекционно-зависимой формы более тяжелое. Отек, хоть и увеличивается медленно, не спадает на протяжении длительного времени. Эта форма БА тяжело поддается лечению при помощи традиционных медикаментов (бета-адреномиметиков, глюкокортикоидов).
Существует несколько механизмов развития бронхиальной астмы после воздействия инфекционных агентов:
- Аллергическая реакция медленного типа.
- Немедленная аллергическая реакция (аналогичная патогенезу атопической формы).
- Механизмы неиммунологического характера.
Реакция замедленного типа, соответственно названию, характеризуется длительным нарастанием отека. При этом для ее запуска требуется неоднократное воздействие аллергического агента. Клетки организма выделяют особые белки – медиаторы воспаления замедленного действия.
Эозинофилы также принимают участие в процессе. Они синтезируют белок, который повреждает реснитчатый эпителий бронхов. В результате его клетки не способны эвакуировать мокроту из просвета органа.
Неиммунологическая реакция развивается при непосредственном повреждении клеток бронхов инфекционными агентами.
Глюкокортикоидная форма
Глюкокортикоиды – это гормоны, вырабатываемые корой надпочечников. Они обладают мощным противовоспалительным действием, угнетают аллергическую реакцию. Поэтому нехватка этих гормонов в организме может как спровоцировать первый приступ, так и стать причиной постоянных рецидивов.
Патогенез влияния недостатка глюкокортикоидов при бронхиальной астме таков:
- Снижается концентрация бета-адренорецепторов на эпителии бронхов, что приводит к снижению восприимчивости к адреналину, расслабляющему мускулатуру бронхов.
- Активность медиаторов воспаления не уменьшается не регулируется гормонами.
- Увеличивается секреция провоспалительных белков и одновременно снижается активность противовоспалительных.
Эта форма бронхиальной астмы чаще всего развивается при длительном лечении глюкокортикоидами. Бесконтрольный прием гормонов влияет на надпочечники, угнетая их функцию.
У девушек гормональная БА может возникать при нарушении баланса половых гормонов. Приступ провоцируется снижением количества прогестерона в крови и повышением уровня эстрогена, что характерно для второй половины менструального цикла.
Нервно-психическая форма

Нервно-психическая форма бронхиальной астмы относится к группе психосоматических заболеваний. Это патологии, при которых длительные стрессы, депрессия, тревога проявляются в виде нарушения функции какого-либо органа и системы.
Для нервно-психической разновидности астмы характерно отсутствие органических изменений стенки бронхов на начальных этапах. Приступ развивается из-за спазма гладкой мускулатуры. Лишь при длительном течении заболевания возникают стойкие изменения в тканях органа.
В основе развития данной формы БА лежит гиперчувствительность эпителия бронхов к гистамину и ацетилхолину. Эти вещества являются нейромедиаторами, которые передают импульсы с периферии в центральную нервную систему.
Кроме того, приступ БА может провоцироваться любой нагрузкой, сопровождающейся глубоким вдохом.
Аспириновая форма
В основе патогенеза бронхиальной астмы аспиринового типа лежит повышенная чувствительность к препаратам, содержащим ацетилсалициловую кислоту. Вещество приводит к нарушению обмена арахидоновой кислоты.
Это, в свою очередь, стимулирует синтез лейкотриенов, которые вызывают спазм бронхиального дерева. Подобный эффект оказывает не только Аспирин, но и другие нестероидные противовоспалительные препараты.
Еще одно негативное свойство салицилатов – снижение активности тромбоцитов. Эти клетки играют важную роль в свертывании крови при травме сосуда и в питании стенок сосудов. Поэтому угнетение функции тромбоцитов повышает ее проницаемость, что провоцирует развитие отека.
Эту форму астмы чаще всего наблюдают у женщин в возрасте 30 – 40 лет. Часто больные аспириновой астмой принимают противовоспалительные препараты из-за болей в спине, суставах и прочее.
Астма физического напряжения

Приступ БА физического напряжения развивается при повышенной физической нагрузке, спустя 5 – 20 минут после ее начала. Некоторые больные отмечают удушье спустя 5 – 10 минут после окончания нагрузок.
В большинстве случаев приступ астмы физического усилия не очень интенсивный. Однако порой приходится прибегать к помощи ингалятора.
Большую часть времени человек дышит носом. Увлажненный, очищенный и теплый воздух благоприятно влияет на дыхательные пути и не раздражает их. При активных физических нагрузках дыхание сбивается, воздух поступает через рот. Он сушит и раздражает слизистую бронхов.
Эпителиальные клетки начинают активно выделять медиаторы воспаления, развивается отек слизистой. Спазм гладких мышц стенки бронхов также принимает участие в развитии приступа.
Патогенез астмы у детей

Патогенез бронхиальной астмы у детей преимущество основан на аллергической реакции. Инфекционно-зависимая форма встречается гораздо реже. Ею обычно страдают дети старшего школьного возраста.
У детей просвет бронхов уже, чем у взрослого, и мускулатура развита хуже. Потому основную роль в развитии приступа у них играет отек и гиперсекреция слизи. В то же время у взрослых на первом месте стоит бронхоспазм. Узким просветом дыхательных путей можно объяснить более тяжелое течение БА в детском возрасте.
Значительное место в этиопатогенезе бронхиальной астмы у детей играет генетическая предрасположенность. Наличие в анамнезе аллергического диатеза, поллинозов, БА у родителей повышают риск развития болезни у ребенка.
У многих детей в качестве аллергенов выступают пищевые продукты. Первый приступ удушья часто развивается в 5 – 6 месяцев, когда малышу начинают давать прикорм. Иногда искусственное питание становится провоцирующим фактором.
В заключение
При бронхиальной астме этиология и патогенез неразрывно связаны. Но вне зависимости от пускового фактора механизм развития приступа БА включат три процесса: отек слизистой, спазм гладких мышц, повышенная секреция слизи.
Заболевание часто предопределяется генетической предрасположенностью. Но нужно понимать, что человек не унаследует от родителей бронхиальную астму.
Ему передастся лишь повышенная чувствительность иммунной системы к определенным аллергенам. То есть наличие астмы у родителей еще не гарантирует ее развитие у ребенка.
Таким образом, патогенез БА сложен и многогранен. Надеемся, эта статья разъяснила особенности механизма развития этого заболевания.
Источник


