Судьба лактата в организме цикл кори

В клетках организма всегда существует потребность в глюкозе:
- для эритроцитов глюкоза является единственным источником энергии,
- нервная ткань потребляет около 120 г глюкозы в сутки и эта величина практически не зависит от интенсивности ее работы. Только в экстремальных ситуациях (длительное голодание) она способна получать энергию из неуглеводных источников (кетоновые тела),
- глюкоза играет весомую роль для поддержания необходимых концентраций метаболитов цикла трикарбоновых кислот (в первую очередь оксалоацетата).
Таким образом, при определенных ситуациях – при низком содержании углеводов в пище, голодании, длительной физической работе, т.е. когда глюкоза крови расходуется и наступает гипогликемия, организм должен иметь возможность синтезировать глюкозу и нормализовать ее концентрацию в крови. Это достигается реакциями глюконеогенеза, идущими в печени.
По определению, глюконеогенез – это синтез глюкозы из неуглеводных компонентов: лактата, пирувата, глицерола, кетокислот цикла Кребса и других кетокислот, из аминокислот.
Необходимость глюконеогенеза и его значение для организма демонстрируют два цикла – глюкозо-лактатный и глюкозо-аланиновый.
Глюкозо-лактатный цикл (цикл Кори)
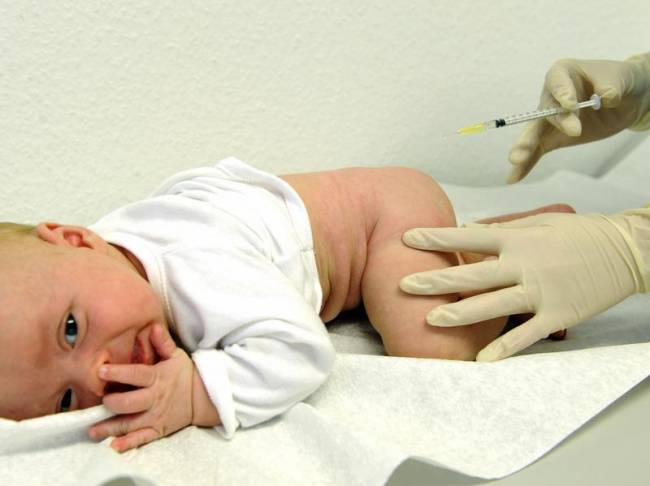
Глюкозо-лактатный цикл – это циклический процесс, объединяющий реакции глюконеогенеза и реакции анаэробного гликолиза. Глюконеогенез происходит в печени, субстратом для синтеза глюкозы является лактат, поступающий в основном из эритроцитов или мышечной ткани.
В эритроцитах молочная кислота образуется непрерывно, так как для них анаэробный гликолиз является единственным способом образования энергии.
В скелетных мышцах высокое накопление молочной кислоты (лактата) является следствием гликолиза при очень интенсивной, субмаксимальной мощности, работе, при этом внутриклеточный рН снижается до 6,3-6,5. Но даже при работе низкой и средней интенсивности в скелетной мышце всегда образуется некоторое количество лактата.
Убрать молочную кислоту можно только одним способом – превратить ее в пировиноградную кислоту. Однако сама мышечная клетка ни при работе, ни во время отдыха не способна превратить лактат в пируват из-за особенностей изофермента лактатдегидрогеназы-5. Зато клеточная мембрана высоко проницаема для лактата и он движется по градиенту концентрации наружу. Поэтому во время и после нагрузки (при восстановлении) лактат легко удаляется из мышцы. Это происходит довольно быстро, всего через 0,5-1,5 часа в мышце лактата уже нет. Малая часть молочной кислоты выводится с мочой.
Большая часть лактата крови захватывается гепатоцитами, окисляется в пировиноградную кислоту и вступает на путь глюконеогенеза. Глюкоза, образованная в печени, используется самим гепатоцитом или возвращается обратно в мышцы, восстанавливая во время отдыха запасы гликогена. Также она может распределиться по другим органам.
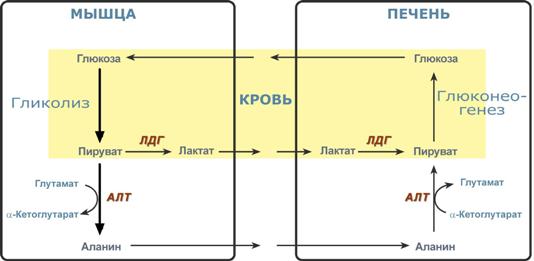
Глюкозо-лактатный (выделен желтым) и глюкозо-аланиновый циклы
Глюкозо-аланиновый цикл
Целью глюкозо-аланинового цикла также является уборка пирувата, но кроме этого решается еще одна немаловажная задача – доставкааминного азота из мышцы в печень.
При мышечной работе и в покое в миоците распадаются белки и образуемые аминокислоты трансаминируются с α-кетоглутаратом и полученный глутамат взаимодействует с пируватом. Образующийся аланин является транспортной формой аминного (аминокислотного) азота и пирувата из мышцы в печень. В гепатоците идет обратная реакция трансаминирования, аминогруппа через глутамат передается на синтез мочевины, пируват используется для синтеза глюкозы.
Кроме мышечной работы, глюкозо-аланиновый цикл активируется во время голодания, когда белки мышц и других тканей распадаются и многие аминокислоты используются в качестве источника энергии, а их азот необходимо доставить в печень.
Источник
Лактат – конечный продукт анаэробного окисления глюкозы в мышцах, особенно в белых мышечных волокнах, где митохондрий меньше, чем в красных. Может включаться в глюконеогенез после окисления до пирувата в лактатдегидрогеназной реакции. При продолжительной физической работе основным источником лактата является скелетная мускулатура, в клетках которой преобладают анаэробные процессы. Накопление молочной кислоты в мышцах ограничивает их работоспособность. Это связано с тем, что при повышении концентрации молочной кислоты в ткани снижается уровень рН (молочнокислый ацидоз). Изменение рН приводит к ингибированию ферментов важнейших метаболических путей. В утилизации образующейся молочной кислоты важное место принадлежитглюкозо-лактатному циклу Кори.
Цикл Кори и глюкозо-аланиновый цикл (пояснения в тексте).
Лактат, образовавшийся в мышцах, переносится кровью в печень, где в процессе глюконеогенеза превращается в глюкозу, которая с током крови может возвращаться в работающую мышцу. В печени часть лактата может окисляться до углекислого газа и воды, превращаться в пируват и вовлекаться в общий путь катаболизма.
Значение цикла Кори:
1. Регуляция постоянного уровня глюкозы в крови.
2. Обеспечивает утилизацию лактата.
3. Предотвращает накопление лактата (снижение рН — лактоацидоз).
4. Экономичное использование углеводов организмом.
Регуляция обмена углеводов осуществляется на уровне тканей – кровь, печень, мышцы.
Глюкогенные аминокислоты, к которым относятся большинство белковых аминокислот. Ведущее место в глюконеогенезе среди аминокислот принадлежит аланину, который может превращаться в пируват путём трансаминирования. При голодании, физической работе и других состояниях в организме функционирует глюкозо-аланиновый цикл, подобный циклу Кори для лактата (рисунок 16.2). Существование цикла аланин – глюкоза препятствует отравлению организма, так как в мышцах нет ферментов, утилизирующих аммиак. В результате тренировки мощность этого цикла значительно возрастает.
Другие аминокислоты могут, подобно аланину, превращаться в пируват, а также в промежуточные продукты цикла Кребса (α-кетоглутарат, фумарат, сукцинил-КоА). Все эти метаболиты способны преобразовываться в оксалоацетат и включаться в глюконеогенез.
Глицерол – продукт гидролиза липидов в жировой ткани.Этот процесс значительно усиливается при голодании. В печени глицерол превращается в диоксиацетонфосфат – промежуточный продукт гликолиза и может быть использован в глюконеогенезе.
Жирные кислоты и ацетил-КоА не являются предшественниками глюкозы. Окисление этих соединений обеспечивает энергией процесс синтеза глюкозы.
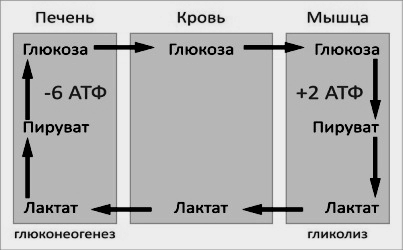
Энергетический баланс. Путь синтеза глюкозы из пирувата (рисунок 16.6) содержит три реакции, сопровождающиеся потреблением энергии АТФ или ГТФ:
а) образование оксалоацетата из пирувата (затрачивается молекула АТФ);
б) образование фосфоенолпирувата из оксалоацетата (затрачивается молекула ГТФ);
в) обращение первого субстратного фосфорилирования – образование 1,3-дифосфоглицерата из 3-фосфоглицерата (затрачивается молекула АТФ).
Каждая из этих реакций повторяется дважды, так как для образования 1 молекулы глюкозы (С6) используются 2 молекулы пирувата (С3). Поэтому энергетический баланс синтеза глюкозы из пирувата составляет – 6 молекул нуклеозидтрифосфатов (4 молекулы АТФ и 2 молекулы ГТФ). При использовании других предшественников энергетический баланс биосинтеза глюкозы отличается.
Источник
Цикл
Кори (глюкозо-лактатный цикл) открыла
чешская ученая, лауреат Нобелевской
премии Тереза
Кори.
Он представляет собой биохимический
транспорт лактата
из мышц в печень и дальнейший синтез
глюкозы
из лактата, катализируемый ферментами
глюконеогенеза:
При
интенсивной мышечной работе и в условиях
отсутствия или недостаточного числа
митохондрий
(например, в эритроцитах)
глюкоза
подвергается анаэробному гликолизу
с образованием лактата.
При накоплении лактата в мышцах возникает
лактат-ацидоз, раздражаются чувствительные
нервные окончания, что вызывает боль в
мышцах.
Лактат
переносится кровью в печень и превращается
в пируват, а затем в глюкозу (глюконеогенез),
которая с током крови может возвращаться
в работающую мышцу.
Направление
лактатдегидрогеназной реакции в
работающих мышцах и печени обусловлено
отношением концентраций восстановленной
и окисленной форм НАД+:
отношение НАД+/НАДН
в сокращающейся мышце больше, чем в
печени.
7.7. Спиртовое брожение
Спиртовое брожение
осуществляется дрожжеподобными
организмами, а также некоторыми плесневыми
грибками:
![]()
Механизм
реакции близок к гликолизу. Расхождение
начинается после этапа образования
пирувата. При гликолизе пируват при
участии фермента ЛДГ и кофермента НАДН
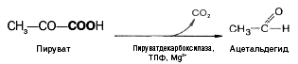
восстанавливается в лактат. При спиртовом
брожении пируват подвергается
декарбоксилированию, в результате
образуется ацетальдегид, а затем при
восстановлении его — этанол:

При молочнокислом
брожении ПВК не декарбоксилируется, а,
как и при гликолизе в животных тканях,
восстанавливается при участии ЛДГ за
счет водорода НАДН.
7.8. Пентозофосфатный путь превращения глюкозы
Пентозофосфатный
путь –
альтернативный путь окисления глюкозы.
Его функции:
—
поставляет клеткам кофермент НАДФН,
использующийся как донор водорода в
реакциях восстановления;
—
обеспечивает клетки пентозофосфатами
для синтеза нуклеотидов и нуклеиновых
кислот.
Пентозофосфатный
путь не приводит к синтезу АТФ.
Ферменты пути
локализованы в цитозоле.
В
пентозофосфатном пути превращения
глюкозы выделяют окислительный и
неокислительный пути образования
пентоз.
Окислительный
путь включает
две реакции дегидрирования. Коферментом
дегидрогеназ является НАДФ+,
восстанавливающийся в НАДФН. Пентозы
образуются при окислительном
декарбоксилировании.
Неокислительный
путь включает
реакции переноса 2- и 3-х углеродный
фрагментов с одной молекулы на другую.
Этот путь служит для синтеза пентоз.
Процесс обратим, и из пентоз могут
образовываться гексозы.
Пентозофосфатный
путь образования пентоз протекает в
печени, жировой ткани, молочной железе,
коре надпочечников, эритроцитах.
1).
Дегидрирование глюкозо-6-фосфата при
участии глюкозо-6-фос-фатдегидрогеназы
и кофермента НАДФ+
с образованием 6-фосфоглюконо--лактона
и НАДФН:
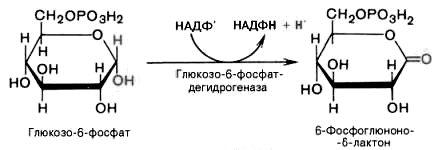
2).
6-фосфоглюконо--лактон
нестабилен и гидролизуется с образованием
6-фосфоглюконата (фермент –
6-фосфоглюконолактоназа):
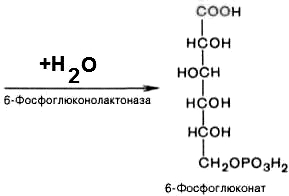
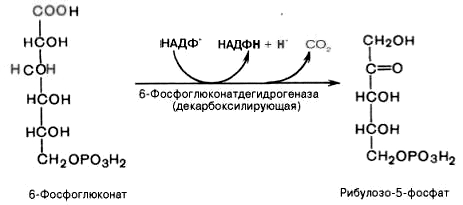
3).
Дегидрирование и декарбоксилирование
6-фосфоглюконата с образованием
рибулозо-5-фосфата (пентоза) и НАДФН при
участии декарбоксилирующей
6-фосфоглюконатдегидрогеназы:
4).
Под действием эпимеразы из рибулозо-5-фосфата
образуется ксилулозо-5-фосфат (пентоза).
Под влиянием изомеразы рибулозо-5-фосфат
превращается в рибозо-5-фосфат (пентоза).
Между формами пентозофосфатов
устанавливается равновесие:
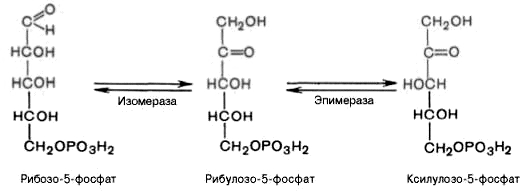
На
этом этапе пентозофосфатный путь может
быть завершен. При других условиях
наступает неокислительная стадия
пентозофосфатного цикла, протекающая
в анаэробных условиях. Она заключается
в переносе двух- и трехуглеродных
фрагментов от одной молекулы к другой.
При этом образуются вещества, характерные
для гликолиза (фруктозо-6-фосфат,
фруктозо-1,6-бисфосфат, фосфотриозы), и
вещества, специфические для пентозофосфатного
пути (седогептулозо-7-фосфат,
пентозо-5-фосфаты, эритрозо-4-фосфат).
Шесть
молекул
глюкозо-6-фосфата в пентозофосфатном
цикле
образуют 6 молекул
рибулозо-5-фосфата и 6 молекул
СО2.
Из 6 молекул
рибулозо-5-фосфата регенерируется 5
молекул
глюкозо-6-фосфата:
![]()
Промежуточные
продукты цикла (фруктозо-6-фосфат и
глицеральдегид-3-фосфат) включаются в
гликолиз.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
СУДЬБА ЛАКТАТА, ОБРАЗОВАВШЕГОСЯ ПРИ ГЛИКОЛИЗЕ
Накопившийся в ходе гликолиза лактат при поступлении кислорода в клетку начинает постепенно превращаться обратно в ПВК. Часть этого пирувата окисляется во втором и третьем этапах ГБФ-пути. АТФ, образующаяся при этом, используется для синтеза из оставшегося количества ПВК глюкозы или гликогена (в условиях покоя). Процесс синтеза глюкозы или гликогена из лактата называется ОБРАЩЕНИЕМ ГЛИКОЛИЗА.
Лактат не является конечным продуктом метаболизма. Дальнейшее использование лактата связано с его превращением в печени в пируват. Направление лактатдегидрогеназной реакции в работающих мышцах и печени обусловлено различным отношением концентраций восстановленной и окисленной форм NAD+ Отношение NAI+/NADH в сокращающейся мышце больше, чем в печени.
Цикл Кори (глюкозолактатный цикл) можно представить в виде последовательности событий (рис 9).
Цикл Кори. 1 — поступление лактата из сокращающейся мышцы с током крови в печень; 2,3— синтез глюкозы из лактата в печени; 4 — поступление глюкозы из печени с током крови в работающую мышцу; 5,6— использование глюкозы как энергетического субстрата сокращающейся мышцей и образование лактата.
Рисунок 9
В мышцах пируват может превращаться также и в аланин. Аланин с кровью транспортируется в печень и там, теряя аминогруппу, превращается в пируват. Эта цепь превращений называетсяглюкозоаланиновым циклом.
Снижение использования лактата в качестве субстрата в синтезе глюкозы, вызванное дефектом ферментов глюконеогенеза, может приводит к повышению концентрации лактата и, следовательно, к понижению рН — лактатацидозу.
СИНТЕЗ ГЛЮКОЗЫ В ПЕЧЕНИ (ГЛЮКОНЕОГЕНЕЗ)
Глюконеогенез — это процесс синтеза глюкозы из веществ неуглеводной природы. У млекопитающих эту функцию выполняет в основном печень, в меньшей мере — почки и клетки слизистой кишечника. Главными субстратами глюконеогенеза являютсяпируват, лактат, глицерин, аминокислоты (рис.10).
Глюконеогенез обеспечивает потребности организма в глюкозе в тех случаях, когда диета содержит недостаточное количество углеводов (физическая нагрузка, голодание). Постоянное поступление глюкозы особенно необходимо для нервной системы и эритроцитов. При понижении концентрации глюкозы в крови ниже определенного критического уровня нарушается функционирование мозга; при тяжелой гипогликемии возникает коматозное состояние и может наступить летальный исход.
Запасов гликогена в организме достаточно для удовлетворения потребностей в глюкозе в период между приемами пищи. При углеводном или полном голодании, а также в условиях длительной физической работы концентрация глюкозы в крови поддерживается за счет глюконеогенеза. В этот процесс могут быть вовлечены вещества, которые способны превратиться в пируват или любой другой метаболит глюконеогенеза. На рисунке показаны пункты включения первичных субстратов в глюконеогенез:
Глюкоза необходима для жировой ткани как источник глицерола, входящего в состав глицеридов; она играет существенную роль в поддержании эффективных концентраций метаболитов цикла лимонной кислоты во многих тканях. Даже в условиях, когда большая часть потребностей организма в калориях обеспечивается за счет жира, всегда сохраняется определенная потребность в глюкозе. Кроме того, глюкоза служит единственным видом топлива для работы скелетной мышцы в анаэробных условиях. Она является предшественником молочного сахара (лактозы) в молочных железах и активно потребляется плодом в период развития. Механизм глюконеогенеза используется для удаления из крови продуктов тканевого метаболизма, например лактата, образующегося в мышцах и эритроцитах, глицерола, непрерывно образующегося в жировой ткани
Включение различных субстратов в глюконеогенез зависит от физиологического состояния организма. Лактат является продуктом анаэробного гликолиза в эритроцитах и работающих мышцах. Глицерин высвобождается при гидролизе жиров в жировой ткани в постабсорбтивный период или при физической нагрузке. Аминокислоты образуются в результате распада мышечных белков.
Семь реакций гликолиза легко обратимы и используются в глюконеогенезе. Но три киназные реакции необратимы и должны шунтироваться (рис. 12). Так, фруктозо-1,6-дифосфат и глюкозо-6-фосфат дефосфорилируются специфическими фосфатазами, а пируват фосфорилируется до образования фосфоенолпирувата посредством двух промежуточных стадий через оксалоацетат. Образование оксалоацетата катализируется пируваткарбоксилазой. Этот фермент содержит в качестве кофермента биотин. Оксалоацетат образуется в митохондриях, транспортируется в цитозоль и включается в глюконеогенез. Следует обратить внимание на то, что каждая из необратимых реакций гликолиза вместе с соответствующей ей необратимой реакцией глюконеогенеза составляют цикл, называемый субстратным:
Таких циклов существует три — соответственно трем необратимым реакциям. Эти циклы служат точками приложения регуляторных механизмов, в результате чего изменяется поток метаболитов либо по пути распада глюкозы, либо по пути ее синтеза.
Направление реакцийпервого субстратного цикла регулируется главным образом концентрацией глюкозы. При пищеварении концентрация глюкозы в крови повышается. Активность глюкокиназы в этих условиях максимальна. Вследствие этого ускоряется гликолитическая реакцияглюкоза ® глюкозо-6-фосфат. Кроме того, инсулин индуцирует синтез глюкокиназы и ускоряет тем самым фосфорилирование глюкозы. Поскольку глюкокиназа печени не ингибируется глюкозо-6-фосфатом (в отличие от гексокиназы мышц), то основная часть глюкозо-6-фосфата направляется по гликолитическому пути.
Превращение глюкозо-6-фосфата в глюкозу катализируется другой специфической фосфатазой—глюкозо-6-фосфатазой. Она присутствует в печени и почках, но отсутствует в мышцах и жировой ткани. Наличие этого фермента позволяет ткани поставлять глюкозу в кровь.
Распад гликогена с образованием глюкозо-1-фосфата осуществляется фосфорилазой. Синтез гликогена идет по совершенно другому пути, через образование уридиндифосфатглюкозы, и катализируетсягликогенсинтазой.
Второй субстратный цикл: превращение фруктозо-1,6-бисфосфата во фруктозо-6-фосфат, катализируется специфическим ферментомфруктозо-1,6-бисфосфатазой. Этот фермент имеется в печени и почках, он был также обнаружен в поперечнополосатых мышцах.
Направление реакцийвторого субстратного цикла зависит от активности фосфофруктокиназы и фосфатазы фруктозо-1,6-бисфосфата. Активность этих ферментов зависит от концентрации фруктозо-2,6-бисфосфата.
Фруктозо-2,6-бисфосфат образуется путем фосфорилирования фруктозо-6-фосфата при участии бифункционального фермента (БИФ), который катализирует также и обратную реакцию.
Киназная активность проявляется, когда бифункциональный фермент находится в дефосфорилированной форме (БИФ-ОН). Дефосфорилированная форма БИФ характерна для абсорбтивного периода, когда инсулин-глюкагоновый индекс высокий.
При низком инсулин-глюкагоновом индексе, характерном для периода длительного голодания, происходят фосфорилирование БИФ и проявление его фосфатазной активности, результатом чего являются снижение количества фруктозо-2,6-бисфосфата, замедление гликолиза и переключение на глюконеогенез.
Киназная и фосфатазная реакции катализируются разными активными центрами БИФ, но в каждом из двух состояний фермента — фосфорилиро-ванном и дефосфорилированном — один из активных центров ингибирован.
Источник