Суспензия при бронхиальной астме
Бронхиальная астма – хроническое воспаление верхних дыхательных путей, возникающее по причине действия раздражителей и сопровождающееся изменением структуры бронхов. БА особенно распространена среди детей.
Медицина обладает набором довольно эффективных медикаментов для облегчения состояния больного при бронхиальной астме.
Специфика терапии БА
Концепция лечения детей в современном мире основывается на том, что прогрессирование заболевания определяется аллергическими реакциями, приводящими к воспалениям верхних дыхательных путей ребенка. Лечение состоит в:
-
 непосредственном создании IgE-ответа;
непосредственном создании IgE-ответа; - снижении высокой чувствительности бронхов;
- увеличении просвета бронхов;
- прекращении спазма;
- устранении воспаления бронхов.
Таким образом, главная задача терапии БА – получение картины клинической ремиссии, снижение острых и хронических признаков, исключение возврата болезни, поддержание нормального функционирования органов дыхания, снижение побочного действия медикаментов и улучшение качества жизни. Согласно GINA, целью терапии БА является устойчивый контроль над ней.
Выбор лекарственных средств основывается на степени тяжести заболевания, соотношении полезных и отрицательных свойств лекарства, их доступности, правилах системы здравоохранения, семейных обстоятельствах пациента.
Препараты от астмы для детей делятся на два типа:
- Базисная терапия. Профилактический прием медикаментов против воспаления бронхов.
- Облегчение признаков во время приступа.
Препараты, созданные для контролирования течения болезни, принимаются каждый день в течение длительного времени.
 Медикаменты для скорой помощи являются быстродействующими, направленными на устранение конкретных острых симптомов БА, и не являются лечебными. Существует несколько способов ввода лекарств в организм пациента:
Медикаменты для скорой помощи являются быстродействующими, направленными на устранение конкретных острых симптомов БА, и не являются лечебными. Существует несколько способов ввода лекарств в организм пациента:
- ингаляционный, осуществляемый при помощи небулайзера, дозированного аэрозольного или порошкового ингалятора. Является наиболее результативным и безопасным;
- пероральный;
- парентеральный.
к оглавлению ↑
Препараты для лечения астмы у детей
Сегодня существует огромное количество лекарственных препаратов, направленных на облегчение симптоматики астмы, купирование приступов и профилактику болезни. Однако для детей могут применяться не многие из них.
к оглавлению ↑
Медикаменты для контроля БА
Препараты этого типа регулярно применяются в течение длительного времени и направлены на увеличение межприступного периода у детей-астматиков. Основными из них можно считать следующие:
Ингаляционные глюкокортикоиды (ИГК) – Беклазон, Пульмикорт. Это одни из самых эффективных контролирующих средств, которые используются также для лечения персистирующей бронхиальной астмы. Они показаны для регулярного приема у больных БА всех степеней тяжести. Эффективность терапии повышается, если лечение начинать как можно раньше. Сначала назначаются высокие дозы ингаляционных глюкокортикоидов.
 После исчезновения признаков дискомфорта дыхания дозировку сокращают в два раза. Обычно это происходит в период со второго по четвертый месяц приема. Внешняя дыхательная функция приходит в норму с шестого по восьмой месяц. Улучшение бронхомоторных тестов замечается с десятого по двенадцатый месяц.
После исчезновения признаков дискомфорта дыхания дозировку сокращают в два раза. Обычно это происходит в период со второго по четвертый месяц приема. Внешняя дыхательная функция приходит в норму с шестого по восьмой месяц. Улучшение бронхомоторных тестов замечается с десятого по двенадцатый месяц.Длительное планомерное лечение приводит к нивелированию симптомов гиперактивности бронхов. Спустя полгода пациент может принимать негормональные противовоспалительные медикаменты, такие как Интап, Тайлед. Поддерживающая терапия ИГК для детей обеспечивает контроль над симптомами БА. У детей дошкольного возраста выявляются положительные результаты. ИГК – это единственный препарат базисной терапии, подходящий для детей, не достигших трехлетнего возраста.
- Кромоны – Кромогексал, Кетотифен. Являются первичной терапией персистирующей БА. Имеют короткий период влияния и более низкую эффективность, чем ИГК. Защищают от непрямых бронхоконстрикторных стимулов, таких как физическое усилие, дым или аллерген. Теперь используются нечасто, так как заменяются низкими дозами ИГК. Эффективность применения кромонов у детей дошкольного возраста не доказана.
-
 Системные глюкокортикоиды – Гидрокортизон, Преднизон. Довольно действенны в лечении, но имеют много нежелательных побочных явлений. Поэтому длительная терапия противопоказана. Вызывают увеличение веса, задержку роста, расстройства психики, остеопороз, иммуносупрессию, стероидный диабет. Назначение детям ограничено из-за вирусных инфекций.
Системные глюкокортикоиды – Гидрокортизон, Преднизон. Довольно действенны в лечении, но имеют много нежелательных побочных явлений. Поэтому длительная терапия противопоказана. Вызывают увеличение веса, задержку роста, расстройства психики, остеопороз, иммуносупрессию, стероидный диабет. Назначение детям ограничено из-за вирусных инфекций. Ингаляционные Бета-2- адреномиметики длительного действия – Фенотерол. Дети показывают хорошую переносимость препарата даже при большом сроке употребления. Средство обладает эффективностью для поддержания контроля БА. Но монотерапия бета2-адреномиметиками увеличивает возможность летального исхода пациента. Поэтому обычно их комбинируют с базовой терапией ИГКС, когда начальные дозы ИГКС не оказывают должного действия.
Длительность положительного эффекта сохраняется в течение 12 часов, лекарство начинает действовать через двадцать минут. К этой группе препаратов относятся также Формотерол, Салметерол, Кленбутерол. Последний имеет вид сиропа, что больше подходит для ребенка. Действие Формотерола начинается быстрее, через три минуты после приема. Максимальный эффект наступает спустя полчаса или час.
-
 Пероральные Бета2 — адреномиметики длительного действия. Это препараты Сальбутамола, которые эффективно и быстро действуют против ночных приступов БА. Сальбутамол отлично купирует симптомы астмы. Используются также как дополнение к ИГК. Имеют некоторые негативные воздействия на сердце, вызывают тревогу и тремор.
Пероральные Бета2 — адреномиметики длительного действия. Это препараты Сальбутамола, которые эффективно и быстро действуют против ночных приступов БА. Сальбутамол отлично купирует симптомы астмы. Используются также как дополнение к ИГК. Имеют некоторые негативные воздействия на сердце, вызывают тревогу и тремор. - Комбинации. Комбинации препаратов могут оказывать боле сильное действие за счет их совокупности. Сочетание двух сильнодействующих веществ в одном ингаляторе – преимущество этих препаратов. Низкая дозировка сочетания ИГК и Бета2-адренометика длительного действия действуют лучше, чем только ИГК. Салметерол и Флутиказон в одном ингаляторе позволяют быстрее добиться контроля над заболеванием. Формотерол с Будесонидом в совместном применении также оказывают больший контроль над БА.
- Метилксантины. К этому типу лекарственных средств относится Теофиллин, оказывающий бронхолитическое действие, устраняющие воспаления. Он способен подавить не только раннюю, но и позднюю стадию реакции астмы, а также контролирует ночные приступы. Но применение в детском возрасте нежелательно, так как лекарство дает побочные быстро возникающие нарушения работы сердца и даже смерть. Поздними последствиями становятся нарушения в поведении и трудности в учебе.
-
 Антагонисты лейкотриеновых рецепторов. Частично защищают, в течение нескольких часов, от спазма бронхов, возникшего из-за физического напряжения. Применяются такие препараты, как Зафирлукаст, Монтелукаст. Применяются при неэффективности низких дох ИГК. Усиливают терапию у детей со средней тяжестью БА или ее тяжелым течением. Антагонисты лейкотриеновых рецепторов также используются как монотерапия. При этом они улучшают функционировании легких у детей старше шести лет, контролируют признаки бронхиальной астмы у детей двухлетнего возраста. Зафирлукаст улучшает дыхание у детей после двенадцати лет с тяжелой формой БА.
Антагонисты лейкотриеновых рецепторов. Частично защищают, в течение нескольких часов, от спазма бронхов, возникшего из-за физического напряжения. Применяются такие препараты, как Зафирлукаст, Монтелукаст. Применяются при неэффективности низких дох ИГК. Усиливают терапию у детей со средней тяжестью БА или ее тяжелым течением. Антагонисты лейкотриеновых рецепторов также используются как монотерапия. При этом они улучшают функционировании легких у детей старше шести лет, контролируют признаки бронхиальной астмы у детей двухлетнего возраста. Зафирлукаст улучшает дыхание у детей после двенадцати лет с тяжелой формой БА. - Антихолинергические препараты. Ипратропия бромид для детей практически не применяется, так как его безопасность и эффективное действие не установлено.
к оглавлению ↑
Препараты для снятия приступа астмы
Часто против свистящего хрипа, кашля и зажатости грудной клетки применяются Бета 2-агонисты, обладающие быстротой воздействия. Потребность в таких медикаментах является вынужденной, поскольку указывает на то, что базовая терапия не дает должного эффекта.
 Слишком большое количество ингаляционных бронхорасширителей приводит к тому, что бронхи перестают реагировать, развивается астматический статус. Это очень опасно, так как может привести к смерти пациента, даже если он получит лекарство. Поэтому лишь дети с адекватной базовой терапией могут жить, как все здоровые люди.
Слишком большое количество ингаляционных бронхорасширителей приводит к тому, что бронхи перестают реагировать, развивается астматический статус. Это очень опасно, так как может привести к смерти пациента, даже если он получит лекарство. Поэтому лишь дети с адекватной базовой терапией могут жить, как все здоровые люди.
Для неотложной помощи используется ингаляционная форма бронхорасширяющих средств, относящихся к группе бета2-агонистов: Сальбутамол, Беротек, Вентолин, Беродуал и другие. Они применяются для снятия острых проявлений, так как хорошо расширяют бронхи.
Таблетированная форма медикаментов, облегчающих признаки, это: Эуфиллин, Теофедрин, Теотард, Теопек. Эуфиллин короткого действия при частом применении негативно сказывается на работе сердечной мышцы. Тяжелые обострения снимают системными таблетированными или внутривенными гормональными препаратами.
Важно подобрать эффективный препарат, а также метод его введения. Баллончик-ингалятор не всегда удобен для детей при использовании. Кроме того, большая часть препарата при использовании баллончика оседает на задней стенке гортани. Существует специальный резервуар для препарата в виде аэрозоля – спейсер, совместно с которым применяется система «легкое дыхание».
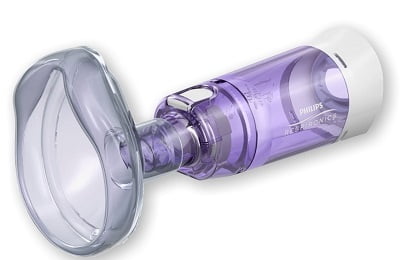 Для порошковых препаратов созданы такие приспособления как дискхалер, циклохалер, турбухалер. Аппарат для перевода медикамента в аэрозоль, небулайзер, дает возможность делать долгую ингаляцию.
Для порошковых препаратов созданы такие приспособления как дискхалер, циклохалер, турбухалер. Аппарат для перевода медикамента в аэрозоль, небулайзер, дает возможность делать долгую ингаляцию.
Препараты от астмы для детей должны применяться только после согласования с врачом. Также стоит помнить, что при самостоятельном использовании ингаляторов детьми возможны передозировки из-за боязни возникновения приступа. Необходимо строго вести контроль над приемом медикаментов у детей.

Бондаренко Татьяна
Эксперт проекта OPnevmonii.ru
Статья помогла вам?
Дайте нам об этом знать — поставьте оценку
Загрузка…
Adblock
detector
Источник
Комментарии
Н.А. Геппе
Московская медицинская академия им. И.М. Сеченова
БРОНХИАЛЬНАЯ АСТМА у детей — широко распространенное заболевание, в основе которого лежит воспаление, ведущее к бронхиальной гиперреактивности и при длительном персистирутошем течении сопровождающееся структурными изменениями дыхательных путей [1, 2]. Раннее лечение с применением противовоспалительных препаратов, включая глюкокортикостероиды, способствует уменьшению тяжести заболевания и снижает риск развития тяжелых обострений. [3, 4].
В современной терапии бронхиальной астмы у детей широко используют лекарственные вещества в виде аэрозолей, преимуществами которых являются быстрое поступление в дыхательные пути, высокая местная активность, низкий риск системных побочных эффектов. Эффективность ингаляции зависит не только от дозы аэрозоля, но и характеристики его частиц, вентиляции, соотношения вдоха и выдоха, анатомии дыхательных путей. Повысить эффективность аэрозольной терапии можно путем использования устройств, обеспечивающих лучшее соотношение между мелкими частицами, попадающими в легкие, и грубыми частицами, оседающими в орофарингеальной области, и создающих стандартное облачко или выброс аэрозоля только в момент ингаляции. Серьезную проблему нередко представляет лечение обострений бронхиальной астмы у детей, которым бывает трудно освоить технику использования дозирующего ингалятора, требующую координации дыхания и ингаляции.
В рекомендациях международной педиатрической группы по астме отмечается, что у детей первых лет жизни, а также детей, не способных пользоваться любой другой системой, необходимо применять небулайзеры с компрессором, который обеспечивает распыление аэрозоля под давлением воздуха [2]. Важное значение применению небулайзеров, как альтернативному методу доставки лекарственных веществ у детей раннего возраста придается в Национальной программе «Бронхиальная астма у детей. Стратегия лечения и профилактика» [1].
Небулайзер — это ингаляционное устройство, предназначенное для распыления аэрозоля с особо мелкодисперсными частицами. Прибор состоит из самого небулайзера и компрессора, создающего поток воздуха не менее 6 л/мин и частицы размером 2-5 им. Применение небулайзера не требует координации ингаляции с дыханием и позволяет создать высокие концентрации лекарственного вещества в легких. У детей небулайзеры можно использовать с первых месяцев жизни. Для введения бронхолитиков небулайзеры применяют при приступе бронхиальной астмы любой тяжести. При этом кривая дозы достигает пика быстрее, чем при использовании дозирующего ингалятора, что обеспечивает более выраженный бронходилатируюший эффект.
К преимуществам небулайзерной терапии помимо отсутствия необходимости в координации дыхания с поступлением аэрозоля можно отнести возможность использования высоких доз лекарственного вещества, непрерывную его подачу с помощью компрессора, отсутствие фреона, который может усилить бронхиальную реактивность, быстрое поступление лекарственного вещества в бронхиальное дерево, портативность устройства [5]. Недостатками являются высокая стоимость, ограниченное число препаратов, предназначенных для небулайзера, необходимость ухода за прибором для исключения контаминации, необходимость источника электрической энергии.
Исследование распределения аэрозоля показало, что у детей на количество аэрозоля, достигающего легких, влияют небольшие размеры ротоглотки, дыхание через нос, высокая частота дыхания [6, 7]. У школьников доля препарата, попадающего в легкие, составляет 3-6%, а у подростков и взрослых варьирует от 2-3 до 9-13%. В другом исследовании распределения аэрозоля при небулайзерной терапии у детей было установлено, что на фильтре внутри маски собирается 11-14% дозы, 16-19% теряется при выдохе и 70% остается в небулайзере [8].
После года инспираторный поток у детей превышает продукцию аэрозоля. Объем выдыхаемого ребенком воздуха увеличивается с возрастом, поэтому концентрация аэрозоля в дыхательных путях уменьшается [9]. Локальная концентрация лекарственного вещества обратно пропорциональна размерам легких, поэтому полагают, что дозу ингаляционного препарата следует рассчитывать с учетом массы тела ребенка.
Очень важным является размер частиц аэрозоля, от которого зависит возможность поступления необходимой дозы препарата в легкие. Частицы аэрозоля характеризуются такими параметрами как стандартный аэродинамический диаметр массы (САДМ), т.е. диаметр, вокруг которого равномерно распределяется масса частиц, и стандартное геометрическое отклонение среднего аэродинамического диаметра. Оптимальные размеры частиц составляют 2-5 нм.
Использование плотно прилегающей маски уменьшает потери аэрозоля у маленьких детей. У детей старше 3 лет лучше использовать мундштук, а не маску. Количество аэрозоля, попадающего в дыхательные пути при вдохе, в том числе оседающего в носу и верхних дыхательных путях, не зависит от роста ребенка после 6 мес [9]. Уменьшение потерь лекарственного вещества вне легких имеет очень большое значение.
Для проведения эффективной ингаляции уже в первые месяцы жизни ребенка разработана модель небулайзера непрерывного действия, приспособленная для низких объемов дыхания детей и подростков (Pan Junior Boy). САДМ аэрозоля в этом устройстве составляет 4,1 нм, доля частиц размером менее 5 нм — 60%, а общий выход — 310 мг/мин. При использовании обычного небулайзера непрерывного действия значительная часть аэрозоля (около 50%) теряется при выдохе. В небулайзерах Pan имеется клапан, который открывается при вдохе и обеспечивает поступление дополнительного внешнего воздуха. Во время выдоха клапан закрывается, что приводит к снижению потока воздуха через камеру и потери аэрозоля при выдохе, так как воздух выходит только через клапан, расположенный около загубника. Эти особенности небулайзера позволяют уменьшить время процедуры и значительно увеличить дозу аэрозоля по сравнению с таковой при использовании обычного небулайзера.
Требования к ингаляционным устройствам, предназначенным для детей, включают в себя портативность, техническую простоту, возможность использования в любое время суток, минимальную координацию при ингаляции. Кооперация детей зависит от многих факторов. Например, ребенок может владеть ингаляционной техникой, но отказывается от выполнения ингаляций. Возраст, в котором удается добиться от ребенка выполнения всех рекомендаций, варьирует в широких пределах. Длительность ингаляции уменьшает приверженность (compliance) детей. Дозирующие аэрозольные ингаляторы требуют точной техники, которой не всегда способны овладеть не только дети, но и взрослые. Меньшая координация требуется при использозании спейсера, хотя наличие интервала между впрыском и вдохом приводит к значительному уменьшению доли частиц аэрозоля, попадающих в легкие. Минимальная координация, необходимая при использовании небулайзера, делает эти устройства наиболее удобными для детей, хотя имеет значение степень пассивной кооперации. Последняя может быть улучшена путем использования лицевой маски.
Для лечения обструкции верхних и нижних дыхательных путей в течение многих лет широко использовались системные глюкокортикостероиды. В последние годы акцент в лечении бронхиальной астмы перенесен на ингаляционные глюкокортикостероиды, обладающие высокой местной активностью и редко вызывающие системные побочные реакции. Небулайзер и дозирующий ингалятор со спейсером имеют разные потенциальные возможности для доставки ингаляционных глюкокортикостероидов.
В первых исследованиях применение небулайзероз для ингаляции кортизона оказалось неэффективным [10, 11], возможно, за счет низкой его растворимости в воде. В последующем предпринимались попытки введения суспензии беклометазона дипропионата с помощью небулайзеров, однако концентрация аэрозоля была низкой, а клинический эффект быстро исчезал [12].Аэрозоли адсорбирующихся стероидов, таких как дексаметазон, гидрокортизон, метилпреднизолон, растворимый преднизолон, у детей использовать не следует.
В настоящее время для небулайзерной терапии применяют будесонид (Пульмикорт, «AstraZeneca») в виде концентрированной суспензии микрочастиц (в пластиковых контейнерах по 2 мл). В 1 мл суспензии содержится 0,5 мг будесонида. Такая суспензия имеет свое распределение частиц, которое не является однообразным в аэрозоле, поэтому профиль лекарственных частиц в аэрозоле отличается от профиля, который получается при распылении раствора.
Будесонид — это негалогенезированный глюкокортикостероид, оказывающий выраженное местное действие и обладающий хорошей переносимостью. Он представляет собой смесь (примерно 1:1) эпимеров 22S и 22R, которые имеют сходные фармакологические свойства. Клиренс будесонида у детей на 50% выше, чем у взрослых. Высокая местная активность и селективность действия препарата обусловлены продолжительным связыванием тканями и высокой инактивацией при первом прохождении через печень. В легких будесонид действует на глюкокортикостероидные рецепторы в течение нескольких часов. Липофильность глюкокортикостероидов является ключевым свойством, определяющим местную противовоспалительную активность, удлинение и увеличение связывания с тканями. При использовании высоких доз будесонида значительная часть препарата конъюгирует с внутриклеточным пулом коэнзима А активатора жирных кислот. Образующиеся зысоколипофильные эфиры, обладающие недостаточным сродством к рецепторам, откладываются в клетке (возможно в субклеточной мембране). Экспериментальные исследования у животных и человека показали, что в 50% или более бронхолегочной ткани будесонид находится а эстерифицированной форме. При активации внутриклеточной липазы начинается медленное высвобождение свободного будесонида. Будесонид сохраняется в тканях дыхательных путей дольше, чем беклометазон дипропионат и флютиказон пропионат. Эти свойства могут обусловлить более длительный противовоспалительный эффект будесонида.
Показания к применению будесонида достаточно широкие. Ниже перечислены заболевания и состояния при которых изучалась эффективность будесонида (Пульмикорта).
- базисная терапия бронхиальной астмы;
- обострение бронхиальной астмы;
- круп;
- бронхолегочная дисплазия;
- обструктивный синдром детей раннего возраста;
- острый бронхиолит;
- восстановительный период бронхиолита;
- аллергический альвеолит;
- состояние после трансплантации легких и сердца-легких.
Эффективность и безопасность суспензии будесонида при бронхиальной астме у детей изучалась в многочисленных исследованиях. В 1998 году опубликованы результаты 12-недельного плацебо-контролируемого исследования суспензии будесонида в дозах 0,25, 0,5 и 1,0 мг два раза в сутки [13], проведенного в 17 центрах в США у 178 детей. Ингаляции производились с помощью струйного небулайзера с воздушным компрессором. Все три дозы имели сходную эффективность. На фоне лечения будесонидом у детей с персистирующей астмой и стероидной зависимостью уменьшались дневные и ночные симптомы астмы, что позволило рассматривать препарат как альтернативу системным глюкокортикостероидам.
Высокая эффективность ингаляций суспензии будесонида два раза в сутки по 5 мин продемонстрирована и в международном многоцентровом плацебо-контролируемом исследовании у детей первых 5 лет жизни с гормонозависимой астмой [14]. У детей, получавших оральные глюкокортикостероиды, применение будесонида через небулайзер (по 1 мг два раза в сутки) позволило добиться большего снижения дозы таблетированных глюкокортикостероидов, чем использование плацебо [15].
В 1999 году в США проведено исследование у 359 детей в возрасте от 6 мес до 8 лет с персистирующей легкой астмой. Будесонид применяли в дозах 0,25, 0,5 и 1,0 мг один раз в сутки в течение 12 недель [16]. Эффект препарата во всех трех дозах проявлялся уже в первые 2 недели и достигал максимума к 4-6-й неделе. Однократное введение будесонида хорошо переносятся и удобно для детей раннего возраста.
Во Франции проведено двойное слепое рандомизированное исследование будесонида у детей в зозрасте 6-30 мес с тяжелой астмой [17]. Критерием тяжести заболевания было наличие трех обострений в течение предыдущих 3 мес или сохранение признаков бронхиальной обструкция более 15 дней несмотря на бронхолитическую терапию. Детям назначали Пульмикорт через небулайзер по 1 мг два раза в сутки или плацебо. В основной группе улучшение состояния больных наблюдали значительно чаще (39%), чем в контрольной группе (44%). По мнению S.Pedersen и соазт [18], в низких дозах будесонид может эффективно уменьшать симптомы и улучшать показатели функции легких, тогда как высокие дозы могут оказаться необходимыми для уменьшения бронхоспазма после физической нагрузки.
В многоцентровом исследовании во Франции сравнивали эффективность будесонида в дозах 0,5 и 2,0 мг/сут в профилактике обострений у детей в возрасте от 5 до 40 мес со средне-тяжелой и тяжелой астмой [19]. В более высокой дозе препарат давал более выраженный эффект. Применение системных стероидов в период обострения потребовалось у 47% детей, получавших будесонид по 0,25 мг два раза в сутки, и 37% детей, которым препарат назначали по 1,0 мг два раза в сутки.
В Швеции оптимальные дозы суспензии будесонида изучались у 102 детей а зозрасте 5-47 мес [20]. В исследование включали детей, у которых симптомы бронхиальной астмы возникали не менее 3 дней в неделю, два раза в неделю появлялись ночные приступы. Пациенты получали по крайней мере три ингаляции бета2-адреномиметиков в неделю через небулайзер. Сравнивали дозы будесонида 0,25 и 1,0 мг 2 раза в сутки. Препарат давал хороший клинический эффект в обеих дозах. Доза 0,5 мг/сут оказалась достаточной для 47% детей. Возможно, большее значение имеет длительность лечения, чем начальная доза будесонида.
Клинические исследования показывают эффективность Пульмикорта у детей как раннего, так и старшего возраста, страдающих гормонозависимой астмой тяжелого течения. Ингаляционная терапия с помощью небулайзера позволяет значительно уменьшить дозу пероральных глюкокортикостероидов или полностью отменить их.
Представляет интерес использование небулайзеров для введения будесонида как альтернативу системной терапии глюкокортикостероидами при обострении астмы. Такие исследования пока немногочислены. В одном из них применение тербуталина в комбинации с Пульмикортом у детей первых 18 мес жизни, страдавших бронхообструктивным синдромом, давало значительно больший эффект, чем применение одного тербуталина или комбинация тербуталнна и преднизолона внутрь [21]. У больных в возрасте 7-13 лет с обострением тяжелой астмы введение будесонида в дозе 2 мг/сут с помощью небулайзера по эффективности не уступало приему преднизолона в дозе 2 мг/кг внутрь. Однако для подтверждения эффективности будесонида в лечении обострений астмы необходимы дальнейшие исследования.
Будесонид в виде суспензии для небулайзера применяли для лечения крупа у детей. Существенное улучшение было отмечено через 2 ч при повторном введении будесонида 1 мг с интервалом 30 мин у детей в возрасте от 4 мес до 5 лет [22]. Применение препарата обеспечивало быстрое исчезновение симптомов и значительное сокращение длительности пребывания в стационаре.
В России Пульмикорт в виде суспензии зарегистрирован в декабре 1998 г. Опыт применения суспензии будесонида через небулайзер а дозе 0,5 мг два раза в сутки у 10 детей (в возрасте 2-6 лет) с бронхиальной астмой и крупом при респираторной вирусной инфекции показал высокую эффективность препарата. Эффект отмечался в первые 2-3 дня, а при крупе — уже через 2-3 ч. Никому из детей не потребовалось парентеральное применение бронхолитиков. У одного ребенка перед ингаляцией будесонида был введен преднизолон внутримышечно.
Быстрое начало действия будесонида на дыхательные пути было показано A.Miller-Larsson в 1990 году в эксперименте на животных [23]. Известно, что будесонид обладает высокой вазоконстрикторной активностью [24], Полагают, что быстрый эффект местных глюкокортикостероидов на дыхательные пути может быть в значительной степени, связан с активацией альфа-адренергических рецепторов, хотя несомненное значение имеет противоспалительная активность.
Терапия ингаляционными глюкокортикостероидов не оказывает существенного влияния на базальный уровень кортизола и уровень гормона после стимуляции АКТГ. По данным исследований будесонида в высоких дозах — от 200 до 800 мкг/сут (ингаляции с помощью Турбухалера), риск подавления функции надпочечников при лечении этим препаратом очень низкий.
После использования все части небулайзера промывают теплой водой, желательно после каждой ингаляции. Возможно использование небольшого количества дезинфицирующего средства (по крайней мере одни раз в день), после чего прибор тщательно ополаскивают и высушивают. После ингаляции глюкокортикостероида рот необходимо прополоскать водой, а при использования маски — умыть лицо ребенка.
Таким образом, использование небулайзера для введения ингаляционных глюкокортикостероидов, внедрение этого метода в педиатрическую практику позволит улучшить результаты лечения детей с бронхиальной астмой, особенно раннего возраста, и снизить потребность в парентеральном введении препаратов. Быстрая ликвидация симптомов бронхиальной обструкции способствует уменьшению тяжести течения обострений.
Литература
1. Национальная программа «Бронхиальная астма у детей. Стратегии лечения и профилактика». 1997.
2. International Paediatric Asthma Counsensus Group. Asthma: a follow-up statement from an international paediatric asthma consensus group. Arch. Dis. Child. 1992 67, 240-248.
3. Asthma in children under five years of age. Thorax 1907, 52 (Suppl. 1). 59-516
4. Гeппе H.A., Корпушкина А.В., Спесивцев В.В. Открытое многоцентровое исследование эффективности и безопасности недокромила натрия при лечении легкой и средне-тяжелой бронхиальной астмы у детей. Русский педиатрический журнал, 1999, 4, 48-52.
5. O’Donohue W. Guidelines for the use of Nebulizere in the home and at comieiliary sites. Chest, 1996, 109 (3), 814-820.
6. Bisgaard Н. Palient related factors in nebulized drug delivery to children Eur. Respir. Rev., 1997, 7 (51), 376-377.
7. Chua H., Collis G. et al. The influence of age on aerosol deposition in children with cystic fibrisis. Eur. Respir. J 1994: 7. 2115-2191.
8. Zainudin В. et al. Influeacs of breathini pauern on lunc deposition and bron-shodiiatory responie to nebulifed Mlbutamol in patients with stible isthma. Thorax. 1988, 43, 917-991.
9. Collis G., Cole C. Dilution of nebulifed aerozoli by air emrainment in children. Lincet. 1990, 336, 341-343.
10. Brockbuk W. et al. Chronic аsthma treated with aerozole hydroconison. Lancer. 1956, 2, 107.
11. Моrrison Smith J. et al. Hydroconisone hemisuccinate by inhalation in children with uthma. Lancet. 1951, 2, 1241-1249.
12. O’Callachan С. et al. Pinicle size of beciometazone dipropionate produced by two nebulaizer and two devices. Thorax. 1916, 45, 109-111.
13. Shapiro G. et al. Efficacy and safety of budesonide inhalation suspension (Pulmicon Repsulf) in young children with inhaled Keroid-dependent peisisien asthma. J. Allerg. Clin. Immunol., 1998, 102, 719-796.
14. Trifi С. et al. Placebo-controlled immunopatolocic eudy of four month of inhaled conicoiteroids in asthma. Аm J Respir. Crit. Care Med., 1994, 150, 17-22.
15. Tinkelman D. et al. Aerosole beclomethasone dipropionate compared with iheo-phyline as primary treatment of chronic in mild to moderate severe uthma in children. Pediatrics. 1993, 92, 64-77.
16. Kemp J. et al. Once-daily budesonide inhalation suspension for the treatment of persistent asthma in infants and young children. Ann. Allergy Immunol., 1999, 83, 231-239.
17. De Blic J. et al. Efficacy of nebulised budesonide in treatment of severe infantile asthma: a double-blind sludy. J. Allergy Clin. Immunol., 1996, 98, 14-20.
18. Pedersen S. et al. Dose response relationships to nebulized budesonide in children with asthma. Am. J. Resp. Crit Care Med.. 1997, 155 (suppl.). A 268.
19. Gnmfeld A., Llsbros D., Oslincili J. et al. Long-lerm study of nebulized budesonide in young children with moderate to severe asthma. Eur. Respir. J., 1994, 7 (Suppl. 18), 278.
20. Wennergren G. et al. Nebulised budesonide for the treatment sf moderate lo severe asthma in infanul and lodllers. Acia Pediatr., 1996, 85, 183-189.
21. Daughbjerg P et al. Comparision between nebulised terbuialine corcicosteroid and systemic corticosteroid for acute wheezing in chidren up to 18 months of age. Acia Paediair., 1993, 82, 547-552.
22. Husby S. et al. Treatment of group with nebulised steroid budesonide a double blind, placebo controlled study. Arch. Dis. Child., 1993, 68, 358.
23. Miller Larsson A., Bmttsand R. et al. Topical and anti-inflammatory activity of the glucocorticosleroid budesonide and airway mucosa. Ag. Actions. 1990, 29.
24. Johansson S. et al. Topical and systemic glucoconicoids potency of budesonide, beclomelasone dipropionate and prednisolone in man. Eur. J. Respir. Dis., 1982, 63 (suppl. 122), 74-82.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник