Взаимосвязь гликолиза и глюконеогенеза цикл кори
Глюконеогенез
— процесс синтеза глюкозы из веществ
неуглеводной природы. Его основной
функцией является поддержание уровня
глюкозы в крови в период длительного
голодания и интенсивных физических
нагрузок. Процесс протекает в основном
в печени и менее интенсивно в корковом
веществе почек, а также в слизистой
оболочке кишечника. Эти ткани могут
обеспечивать синтез 80-100 г глюкозы в
сутки. На долю мозга при голодании
приходится большая часть потребности
организма в глюкозе. Это объясняется
тем, что клетки мозга не способны, в
отличие от других тканей, обеспечивать
потребности в энергии за счёт окисления
жирных кислот .Кроме мозга, в глюкозе
нуждаются ткани и клетки, в которых
аэробный путь распада невозможен или
ограничен, например эритроциты (они
лишены митохондрий), клетки сетчатки,
мозгового слоя надпочечников и др.
Первичные субстраты глюконеогенеза —
лактат, аминокислоты и глицерол. Включение
этих субстратов в глюконеогенез зависит
от физиологического состояния организма.
Лактат
— продукт анаэробного гликолиза. Он
образуется при любых состояниях
организма в эритроцитах и работающих
мышцах. Таким образом, лактат используется
в глюконеогенезе постоянно.Глицерол
высвобождается при гидролизе жиров в
жировой ткани в период голодания или
при длительной физической нагрузке.Аминокислоты
образуются в результате распада мышечных
белков и включаются в глюконеогенез
при длительном голодании или
продолжительной мышечной работе.
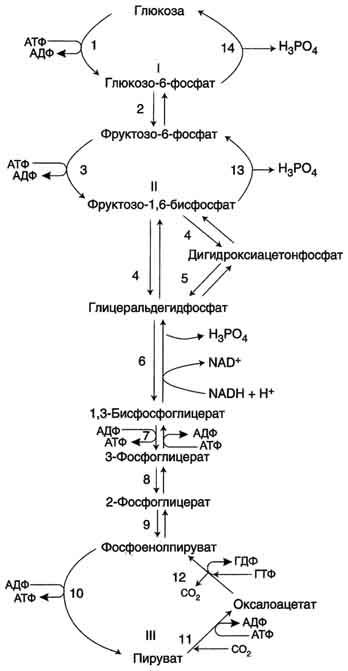
Большинство
реакций глюконеогенеза протекает за
счёт обратимых реакций гликолиза и
катализируется теми же ферментами.
Однако 3 реакции гликолиза термодинамически
необратимы. На этих стадиях реакции
глюконеогенеза протекают другими
путями. Необходимо отметить, что гликолиз
протекает в цитозоле, а часть реакций
глюконеогенеза происходит в митохондриях.
Образование
фосфоенолпирувата из пирувата .
Образование
фосфоенолпирувата из пирувата происходит
в ходе двух реакций первая из которых
протекает в митохондриях. Пируват,
образующийся из лактата или из некоторых
аминокислот, транспортируется в матрикс
митохондрий и там карбоксилируется с
образованием оксалоацетата.
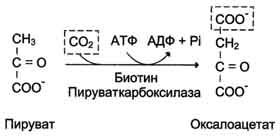
Пируват-карбоксилаза, катализирующая
данную реакцию, — митохондриальный
фермент, коферментом которого является
биотин. Реакция протекает с использованием
АТФ.
Дальнейшие
превращения оксалоацетата протекают
в цитозоле. Следовательно, на этом этапе
должна существовать система транспорта
оксалоацетата через митохондриальную
мембрану, которая для него непроницаема.
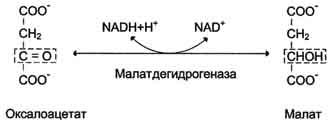
Оксалоацетат в митохондриальном матриксе
восстанавливается с образованием малата
при участии NADH (обратная реакция
цитратного цикла).
Образовавшийся
малат затем проходит через митохондриальную
мембрану с помощью специальных
переносчиков. Кроме того, оксалоацетат
способен транспортироваться из
митохондрий в цитозоль в виде аспартата
в ходе малат-аспартатного челночного
механизма. В
цитозоле малат вновь превращается в
оксалоацетат в ходе реакции окисления
с участием кофермента NAD+.
Обе реакции: восстановление оксалоацетата
и окисление малага катализируют
малатдегидрогеназа, но в первом случае
это митохондриальный фермент, а во
втором — цитозольный. Образованный в
цитозоле из ма-лата оксалоацетат затем
превращается в фосфоенолпируват в ходе
реакции, катализируемой
фосфоенолпируваткарбоксикиназой —
ГТФ-зависимым ферментом.
Образование
глюкозы из лактата.
Лактат, образовавшийся в интенсивно
работающих мышцах или в клетках с
преобладающим анаэробным способом
катаболизма глюкозы, поступает в кровь,
а затем в печень. В печени отношение
NADH/NAD+ ниже,
чем в сокращающейся мышце, поэтому
лактатдегидрогеназная реакция протекает
в обратном направлении, т.е. в сторону
образования пирувата из лактата. Далее
пируват включается в глюконеогенез, а
образовавшаяся глюкоза поступает в
кровь и поглощается скелетными мышцами.
Эту последовательность событий
называют «глюкозо-лактатным
циклом», или «циклом Кори«.
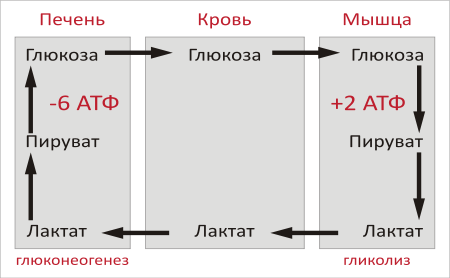
Цикл
Кори выполняет 2 важнейшие функции: 1 —
обеспечивает утилизацию лактата; 2 —
предотвращает накопление лактата и,
как следствие этого, опасное снижение
рН (лактоацидоз). Часть пирувата,
образованного из лактата, окисляется
печенью до СО2 и
Н2О.
Энергия окисления может использоваться
для синтеза АТФ, необходимого для реакций
глюконеогенеза.
Образование
глюкозы из аминокислот.
Аминокислоты, которые при катаболизме
превращаются в пируват или метаболиты
цитратного цикла, могут рассматриваться
как потенциальные предшественники
глюкозы и гликогена и носят название
гликогенных. Например, окса-лоацетат,
образующийся из аспарагиновой кислоты,
является промежуточным продуктом как
цитратногр цикла, так и глюконеогенеза.
Из всех аминокислот, поступающих в
печень, примерно 30% приходится на долю
аланина. Это объясняется тем, что при
расщеплении мышечных белков образуются
аминокислоты, многие из которых
превращаются сразу в пируват или сначала
в оксалоацетат, а затем в пируват.
Последний превращается в аланин,
приобретая аминогруппу от других
аминокислот. Аланин из мышц переносится
кровью в печень, где снова преобразуется
в пируват, который частично окисляется
и частично включается в глюкозонеогенез.
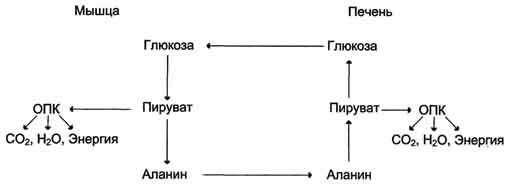
Следовательно, существует следующая
последовательность событий (глюкозо-аланиновый
цикл):
глюкоза в мышцах → пируват в мышцах →
аланин в мышцах → аланин в печени →
глюкоза в печени → глюкоза в мышцах.
Весь
цикл не приводит к увеличению количества
глюкозы в мышцах, но он решает проблемы
транспорта аминного азота из мышц в
печень и предотвращает лактоацидоз.
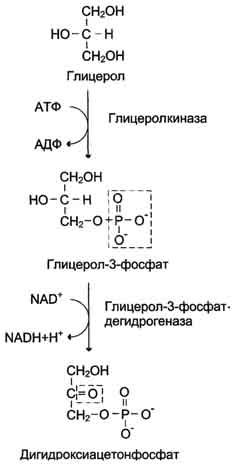
Образование
глюкозы из глицерола.
Глицерол образуется при гидролизе
триацил-глицеролов, главным образом в
жировой ткани. Использовать его могут
только те ткани, в которых имеется
фермент глицерол киназа, например
печень, почки. Этот АТФ-зависимый фермент
катализирует превращение глицерола в
α-глицерофосфат (глицерол-3-фосфат). При
включении глицерол-3-фосфата в
глюконеогенез происходит его
дегидрирование NAD-зависимой дегидрогеназой
с образованием дигидроксиацетонфосфата,
который далее превращается в глюкозу.

35.35 Представление
о пентозофосфатном пути превращений
глюкозы. Окислительные реакции (до
стадии рибулозо-5-фосфата). Распространение
и суммарные результаты этого пути
(образование пентоз, НАДФН и энергетика)
Пентозофосфатный
путь, называемый также гексомонофосфатным
шунтом, служит альтернативным путём
окисления глюкозо-6-фосфата. Пентозофосфатный
путь состоит из 2 фаз (частей) — окислительной
и неокислительной.
В
окислительной фазе глюкозо-6-фосфат
необратимо окисляется в пентозу —
рибулозо-5-фосфат, и образуется
восстановленный NADPH. В неокислительной
фазе рибулозо-5-фосфат обратимо
превращается в рибозо-5-фосфат и метаболиты
гликолиза. Пентозофосфатный путь
обеспечивает клетки рибозой для синтеза
пуриновых и пиримидиновых нуклеотидов
и гидрированным коферментом NADPH, который
используется в восстановительных
процессах. Суммарное уравнение
пентозофосфатного пути выражается
следующим образом:
3
Глюкозо-6-фосфат + 6 NADP+ →
3 СО2 +
6 (NADPH + Н+) + 2 Фруктозо-6-фосфат
+ Глицеральдегид- 3 -фосфат.
Ферменты
пентозофосфатного пути, так же, как и
ферменты гликолиза, локализованы в
цитозоле. Наиболее активно пентозофосфатный
путь протекает в жировой ткани, печени,
коре надпочечников, эритроцитах, молочной
железе в период лактации, семенниках.
В
окислительной части пентозофосфатного
путиглюкозо-6-фосфат подвергается
окислительному декарбоксилированию,
в результате которого образуются
пентозы. Этот этап включает 2 реакции
дегидрирования.
Первая
реакция дегидрирования — превращение
глюкозо-6-фосфата в глюконолактон-6-фосфат
— катализируется NАDР+-зависимой
глюкозо-6-фосфатдегидрогеназой и
сопровождается окислением альдегидной
группы у первого атома углерода и
образованием одной молекулы восстановленного
кофермента NADPH. Далее глюконолактон-6-фосфат
быстро превращается в 6-фосфоглюконат
при участии фермента глюконолактонгидратазы.
Фермент 6-фосфоглюконатдегидрогеназа
катализирует вторую реакцию дегидрирования
окислительной части, в ходе которой
происходит также и декарбоксилирование.
При этом углеродная цепь укорачивается
на один атом углерода, образуется
рибулозо-5-фосфат и вторая молекула
гидрированного NADPH. Восстановленный
NADPH ингибирует первый фермент окислительного
этапа пентозофосфатного пути —
глюкозо-6-фосфатдегидрогеназу. Превращение
NADPH в окисленное состояние NADP+ приводит
к ослаблению ингибирования фермента.
При этом скорость соответствующей
реакции возрастает, и образуется большее
количество NADPH.
Суммарное
уравнение окислительного
этапа пентозофосфатногопути можно представить в виде:
Глюкозо-6-фосфат
+ 2 NADP+ +
Н2О → Рибулозо-5-фосфат +
2 NADPH + Н+ +
СО2.
Реакции
окислительного этапа служат основным
источником NADPH в клетках. Гидрированные
коферменты снабжают водородом
биосинтетические процессы,
окислительно-восстановительные реакции,
включающие защиту клеток от активных
форм кислорода.
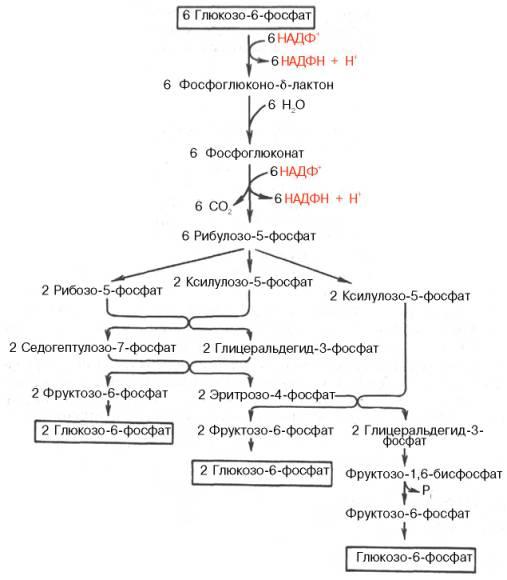
Окислительный
этап образования пентоз и неокислительный
этап (путь возвращения пентоз в гексозы)
составляют вместе циклический процесс.
Такой процесс можно описать общим
уравнением:
6
Глюкозо-6-фосфат + 12 NADP+ +
2 Н2О → 5 Глюкозо-6-фосфат
+ 12 NADPH +12 Н+ +
6 СO2.
Это
означает, что из 6 молекул глюкозы
образуются 6 молекул рибулозо-5-фосфат
(пентозы) и 6 молекул СО2. Ферменты
неокислительнойфазы
превращают 6 молекул рибулозо-5-фосфат
в 5 молекул глюкозы (гексозы). При
последовательном проведении этих
реакций единственным полезным продуктом
является NADPH, образующийся в окислительной
фазе пентозофосфатного пути. Такой
процесс называют пентозофосфатным
циклом. Протекание пентозофосфатного
цикла позволяет клеткам продуцировать
NADPH, необходимый для синтеза жиров, не
накапливая пентозы.
Энергия,
выделяющаяся при распаде глюкозы,
трансформируется в энергию
высокоэнергетического донора водорода
— NADPH. Гидрированный NADPH служит источником
водорода для восстановительных синтезов,
а энергия NADPH преобразуется и сохраняется
во вновь синтезированных веществах,
например жирных кислотах,
высвобождается при их катаболизме и
используется клетками.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Биосинтез глюкозы (глюконеогенез) из аминокислот, глицерина и молочной кислоты. Взаимосвязь гликолиза в мышцах и глюконеогенеза в печени (цикл Кори).
Глюконеогенез — процесс синтеза глюкозы из веществ неуглеводной природы. Его основной функцией является поддержание уровня глюкозы в крови в период длительного голодания и интенсивных физических нагрузок. Процесс протекает в основном в печени и менее интенсивно в корковом веществе почек, а также в слизистой оболочке кишечника. Эти ткани могут обеспечивать синтез 80-100 г глюкозы в сутки. На долю мозга при голодании приходится большая часть потребности организма в глюкозе. Это объясняется тем, что клетки мозга не способны, в отличие от других тканей, обеспечивать потребности в энергии за счёт окисления жирных кислот .Кроме мозга, в глюкозе нуждаются ткани и клетки, в которых аэробный путь распада невозможен или ограничен, например эритроциты (они лишены митохондрий), клетки сетчатки, мозгового слоя надпочечников и др. Первичные субстраты глюконеогенеза — лактат, аминокислоты и глицерол. Включение этих субстратов в глюконеогенез зависит от физиологического состояния организма.
- Лактат — продукт анаэробного гликолиза. Он образуется при любых состояниях организма в эритроцитах и работающих мышцах. Таким образом, лактат используется в глюконеогенезе постоянно.
- Глицерол высвобождается при гидролизе жиров в жировой ткани в период голодания или при длительной физической нагрузке.
- Аминокислоты образуются в результате распада мышечных белков и включаются в глюконеогенез при длительном голодании или продолжительной мышечной работе.
Большинство реакций глюконеогенеза протекает за счёт обратимых реакций гликолиза и катализируется теми же ферментами. Однако 3 реакции гликолиза термодинамически необратимы. На этих стадиях реакции глюконеогенеза протекают другими путями. Необходимо отметить, что гликолиз протекает в цитозоле, а часть реакций глюконеогенеза происходит в митохондриях.

- Образование фосфоенолпирувата из пирувата . Образование фосфоенолпирувата из пирувата происходит в ходе двух реакций первая из которых протекает в митохондриях. Пируват, образующийся из лактата или из некоторых аминокислот, транспортируется в матрикс митохондрий и там карбоксилируется с образованием оксалоацетата.

Пируват-карбоксилаза, катализирующая данную реакцию, — митохондриальный фермент, коферментом которого является биотин. Реакция протекает с использованием АТФ.
Дальнейшие превращения оксалоацетата протекают в цитозоле. Следовательно, на этом этапе должна существовать система транспорта оксалоацетата через митохондриальную мембрану, которая для него непроницаема. Оксалоацетат в митохондриальном матриксе восстанавливается с образованием малата при участии NADH (обратная реакция цитратного цикла).

Образовавшийся малат затем проходит через митохондриальную мембрану с помощью специальных переносчиков. Кроме того, оксалоацетат способен транспортироваться из митохондрий в цитозоль в виде аспартата в ходе малат-аспартатного челночного механизма. В цитозоле малат вновь превращается в оксалоацетат в ходе реакции окисления с участием кофермента NAD+. Обе реакции: восстановление оксалоацетата и окисление малага катализируют малатдегидрогеназа, но в первом случае это митохондриальный фермент, а во втором — цитозольный. Образованный в цитозоле из ма-лата оксалоацетат затем превращается в фосфоенолпируват в ходе реакции, катализируемой фосфоенолпируваткарбоксикиназой — ГТФ-зависимым ферментом.
- Образование глюкозы из лактата. Лактат, образовавшийся в интенсивно работающих мышцах или в клетках с преобладающим анаэробным способом катаболизма глюкозы, поступает в кровь, а затем в печень. В печени отношение NADH/NAD+ ниже, чем в сокращающейся мышце, поэтому лактатдегидрогеназная реакция протекает в обратном направлении, т.е. в сторону образования пирувата из лактата. Далее пируват включается в глюконеогенез, а образовавшаяся глюкоза поступает в кровь и поглощается скелетными мышцами. Эту последовательность событий называют «глюкозо-лактатным циклом», или «циклом Кори».

Цикл Кори выполняет 2 важнейшие функции: 1 — обеспечивает утилизацию лактата; 2 — предотвращает накопление лактата и, как следствие этого, опасное снижение рН (лактоацидоз). Часть пирувата, образованного из лактата, окисляется печенью до СО2 и Н2О. Энергия окисления может использоваться для синтеза АТФ, необходимого для реакций глюконеогенеза.
- Образование глюкозы из аминокислот. Аминокислоты, которые при катаболизме превращаются в пируват или метаболиты цитратного цикла, могут рассматриваться как потенциальные предшественники глюкозы и гликогена и носят название гликогенных. Например, окса-лоацетат, образующийся из аспарагиновой кислоты, является промежуточным продуктом как цитратногр цикла, так и глюконеогенеза. Из всех аминокислот, поступающих в печень, примерно 30% приходится на долю аланина. Это объясняется тем, что при расщеплении мышечных белков образуются аминокислоты, многие из которых превращаются сразу в пируват или сначала в оксалоацетат, а затем в пируват. Последний превращается в аланин, приобретая аминогруппу от других аминокислот. Аланин из мышц переносится кровью в печень, где снова преобразуется в пируват, который частично окисляется и частично включается в глюкозонеогенез. Следовательно, существует следующая последовательность событий (глюкозо-аланиновый цикл): глюкоза в мышцах → пируват в мышцах → аланин в мышцах → аланин в печени → глюкоза в печени → глюкоза в мышцах. Весь цикл не приводит к увеличению количества глюкозы в мышцах, но он решает проблемы транспорта аминного азота из мышц в печень и предотвращает лактоацидоз.

- Образование глюкозы из глицерола. Глицерол образуется при гидролизе триацил-глицеролов, главным образом в жировой ткани. Использовать его могут только те ткани, в которых имеется фермент глицерол киназа, например печень, почки. Этот АТФ-зависимый фермент катализирует превращение глицерола в α-глицерофосфат (глицерол-3-фосфат). При включении глицерол-3-фосфата в глюконеогенез происходит его дегидрирование NAD-зависимой дегидрогеназой с образованием дигидроксиацетонфосфата, который далее превращается в глюкозу.

Источник
Так как синтез и окисление глюкозы являются крайне важными для существования клетки (гликолиз) и всего организма (глюконеогенез), то регуляция этих процессов отвечает запросам органов и тканей при различных условиях.
Поскольку гликолитическое окисление глюкозы
- является способом получения энергии в аэробных и анаэробных условиях, то оно непрерывно происходит во всех клетках и, конечно, должно и будет активировано при усилении работы клетки, например, сокращение миоцита, движение нейтрофилов;
- служит источником глицерола и ацетил-SКоА, используемых для синтеза жиров в гепатоцитах и адипоцитах, то такое окисление активируется при избытке глюкозы в этих клетках.
Глюконеогенез, как образование глюкозы в печени из неуглеводных источников, необходим:
- при гипогликемии во время мышечной нагрузки – синтез глюкозы из молочной кислоты, поступающей из работающих мышц, и из глицерола, образующегося при мобилизации жиров;
- при гипогликемии при кратком голодании (до 24 часов) – синтез преимущественно из молочной кислоты, непрерывно поступающей в печень из эритроцитов,
- при гипогликемии при длительном голодании – в основном синтез из аминокислот, образующихся при катаболизме белков, и также из молочной кислоты и глицерина.
Таким образом, глюконеогенез, идущий в печени, обеспечивает глюкозой все остальные клетки и органы (эритроциты, нервная ткань, мышцы и др.), в которых активны процессы, требующие глюкозу. Поступление глюкозы в эти клетки также необходимо, чтобы поддержать концентрацию оксалоацетата и обеспечить сгорание в ЦТК ацетил-SКоА, получаемого из жирных кислот или кетоновых тел.
В целом можно выделить два способа регуляции гликолиза и глюконеогенеза: гормональная при участии гормонов и метаболическая, т.е. при помощи промежуточных или конечных продуктов обмена глюкозы.
Существуют три основных участка, на которых происходит регуляция этих процессов:
- первая реакция гликолиза,
- третья реакция гликолиза и обратимая ей,
- десятая реакция гликолиза и обратимые ей.
Регуляция глюконеогенеза
Гормональная активация глюконеогенеза осуществляется глюкокортикоидами, которые увеличивают синтез пируваткарбоксилазы, фосфоенолпируват-карбоксикиназы, фруктозо-1,6-дифосфатазы. Глюкагон стимулирует те же самые ферменты через аденилатциклазный механизм путем фосфорилирования.
Энергия для глюконеогенеза поступает от β-окисления жирных кислот. Конечный продукт этого окисления, ацетил-SКоА аллостерически стимулирует активность первого фермента глюконеогенеза – пируваткарбоксилазы. Кроме этого, фруктозо-1,6-дифосфатаза стимулируется при участии АТФ.
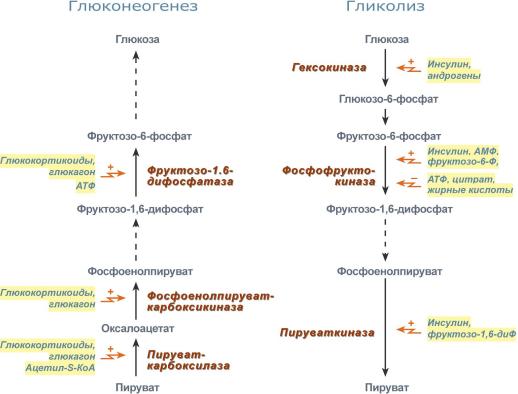
Гормональные и метаболические факторы, регулирующие гликолиз и глюконеогенез
Регуляция гликолиза
Гормональная регуляция
В печени гликолиз стимулируется инсулином, повышающим количество ключевых ферментов гликолиза (гексокиназы, фосфофруктокиназы, пируваткиназы).
В печени активность глюкокиназы, кроме инсулина, регулируется другими гормонами:
- активацию вызывает андрогены,
- подавляют ее активность глюкокортикоиды и эстрогены.
В других тканях активность гексокиназ
- повышается тиреоидными гормонами,
- снижается – глюкокортикоидами и соматотропином.
Метаболическая регуляция
Гексокиназа непеченочных клеток ингибируется продуктом собственной реакции – глюкозо-6-фосфатом.
Фосфофруктокиназа:
- активируется АМФ и собственным субстратом (фруктозо-6-фосфат),
- ингибируется – АТФ, лимонной кислотой, жирными кислотами.
Пируваткиназа активируется фруктозо-1,6-дифосфатом (прямая положительная регуляция).
Молекулы АМФ, стимулирующие гликолиз, образуются в аденилаткиназной реакции, активируемой при появлении избытка АДФ. Особенно ярко значение такой регуляции проявляется при мышечной работе:
АДФ + АДФ ↔ АТФ + АМФ
Источник


